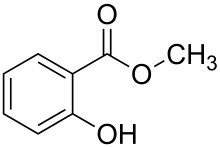
Salicylsäuremethylester
Salicylsäuremethylester, auch Methylsalicylat, ist der Methylester der Salicylsäure. Salicylsäuremethylester wird auch als Wintergrünöl oder Gaultheriaöl bezeichnet, da es mittels Wasserdampfdestillation aus den Blättern der Gattungen Pyrola (Wintergrün) und Gaultheria (Scheinbeeren) isoliert werden kann.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Salicylsäuremethylester | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C8H8O3 | |||||||||||||||||||||
| Kurzbeschreibung | ||||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 152,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||||||||
| Dichte |
1,18 g·cm−3[4] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
223 °C[4] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Brechungsindex |
1,535 (20 °C)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Vorkommen

Zu Pflanzen, die größere (das heißt riechbare) Mengen Salicylsäuremethylester produzieren, gehören:
- viele Arten der Familie der Heidekrautgewächse, besonders die Varietäten der Niederen Scheinbeere (Wintergrünsträucher) sowie das Echte Mädesüß (Filipendula ulmaria), wo der Wirkstoff in den Wurzeln vorkommt.
- einige Arten der Birken, insbesondere die Zucker-Birke, aber auch die Gelb-Birke.
Die Zucker-Birke war früher Hauptquelle für Salicylsäuremethylester. Das Produkt aus den Blättern der Wintergrünsträucher ist als Wintergreen Oil bekannt.
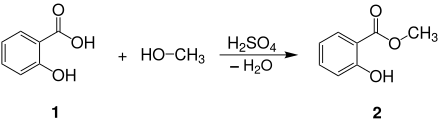
Herstellung
Salicylsäuremethylester 2 wird durch Veresterung von Salicylsäure 1 mit Methanol gewonnen, wobei Schwefelsäure als Katalysator verwendet wird:
Verwendung
Salicylsäuremethylester in der synthetischen Form wird äußerlich in Salben und anderen Einreibemitteln als durchblutungsförderndes (hyperämisierendes) Mittel eingesetzt,[7] etwa bei rheumatischen Beschwerden.[8] Auch in Form von Badezusätzen kommt es zu diesem Zweck zur Anwendung. Bevorzugt in der natürlichen Form als Wintergrünöl verwendet man es für kosmetische Mittel und Mundpflegemittel,[7] ferner auch in Parfümerie und Lebensmittelindustrie, da es einen sehr charakteristischen Geruch besitzt.
Das im Wesentlichen Salicylsäuremethylester enthaltende ätherische Öl des Wintergrüns wird in der Mikroskopie noch heute für Aufhellungspräparate nach Spalteholz gebraucht.
In Nordamerika bieten so gut wie alle Kaugummihersteller neben den klassischen Geschmacksrichtungen wie Pfefferminz auch den Geschmack Wintergreen an, in dem Salicylsäuremethylester enthalten ist. In Europa konnte sich diese Geschmacksrichtung in Kaugummis bisher nicht durchsetzen; viele Europäer empfinden den Geschmack als klinisch zahnarztähnlich und nicht schmackhaft. Auch in Snus wird die Geschmacksrichtung in Amerika und Skandinavien häufig angeboten.
Die in Deutschland noch am weitesten bekannten Produkte mit Wintergrün-Aroma sind die Lutschdragée-Marke Tic Tac des italienischen Süßwarenherstellers Ferrero und die Kaugummi-Marke Bazooka des US-amerikanischen Herstellers Topps Company, welche bis Ende der achtziger Jahre vom deutschen Süßwarenhersteller August Storck in Lizenz produziert und vertrieben wurde. Heutzutage sind Wintergreen-Kaugummis und -Pastillen in Deutschland ausschließlich als Importwaren, beispielsweise in American-Outlet-Stores erhältlich.
Wegen des intensiven Geruchs versuchte man bei den Farbenfabriken vorm. Friedr. Bayer & Co. Salicylsäuremethoxymethylester[9][10][11] als Alternative anzubieten. Er wurde von Arthur Eichengrün in der Pharmazeutischen Zeitung von 1902[12][13] unter dem Handelsnamen Mesotan vorgestellt.
In der 1930er Jahren wurde Wintergrünöl von Imkern und Bieneninstituten zu Behandlung gegen die Milbenseuche in Bienenstöcken eingesetzt.[14]
Nebenwirkungen und Anwendungseinschränkungen
Salicylsäuremethylester sollte während der Schwangerschaft möglichst nicht eingesetzt werden, da keine ausreichenden Daten vorliegen. Bei Anwendung handelsüblicher Präparate auf der Haut sind im Allgemeinen keine toxischen Wirkungen zu erwarten, da Serumspiegel über 50 µg/ml kaum erreicht werden. Bei nicht bestimmungsgemäßem Gebrauch wie etwa längerfristiger oder größflächiger Anwendung oder dem Aufbringen auf nicht intakte Haut sind wegen einer möglichen systemischen Salicylatwirkung Nebenwirkungen wie Schwindel, Ohrensausen, Übelkeit oder andere Magen-Darm-Beschwerden und eine Beeinflussung des Blutgerinnungssystems nicht auszuschließen.[15] In den USA soll eine Leichtathletin an einer Überdosierung des Wirkstoffs gestorben sein.[16]
Botanischer Hintergrund
Salicylsäuremethylester kann giftig wirken, besonders, wenn es eingenommen wird. Pflanzen, die Salicylsäuremethylester enthalten, könnten es als Abschreckung gegen Fressfeinde entwickelt haben. Salicylsäuremethylester kann aber auch von Pflanzen als Pheromon genutzt werden, um andere Pflanzen vor Krankheitserregern, wie dem Tabakmosaikvirus, zu warnen. Wenn die Pflanze von Insekten befallen ist, kann Salicylsäuremethylester als Anlockstoff für nützliche Insekten dienen, welche die angreifenden Insekten töten. Viele Pflanzen produzieren kleine Mengen Salicylsäuremethylester.
Chemische Eigenschaften
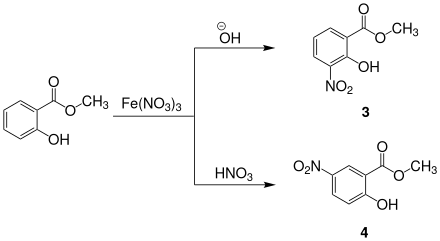
Salicylsäuremethylester kann mit Eisen(III)-nitrat nitriert werden. Es entsteht ein Isomerengemisch aus dem 3- und dem 5-Nitroderivat. In Anwesenheit von Salpetersäure entsteht hauptsächlich 5-Nitrosalicylsäuremethylester 4, im basischen Milieu hauptsächlich 3-Nitrosalicylsäuremethylester 3.[17]
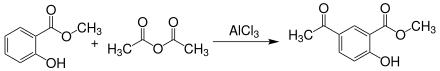
Die Acetylierung von Salicylsäuremethylester mit Essigsäureanhydrid in Gegenwart von Aluminiumchlorid als Katalysator findet mit sehr guten Ausbeuten am C5-Kohlenstoff statt.[18]
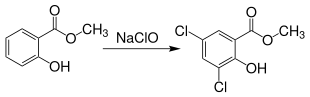
Durch die Reaktion mit Natriumhypochlorit können bis zu zwei Chloratome in den Benzolkern eingeführt werden, es entsteht 3,5-Dichlorsalicylsäuremethylester.[19]
Bei der Reaktion mit elementarem Brom wird ein Bromatom an der Position 5 angelagert.[20]
Risikobewertung
Salicylsäuremethylester wurde 2013 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Salicylsäuremethylester waren die Besorgnisse bezüglich Verbraucherverwendung und hoher (aggregierter) Tonnage sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Substanzen. Die Neubewertung läuft seit 2015 und wird von Frankreich durchgeführt. Um zu einer abschließenden Bewertung gelangen zu können, wurden weitere Informationen nachgefordert.[21]
Weiterführende Literatur
- T. Y. Chan: The risk of severe salicylate poisoning following the ingestion of topical medicaments or aspirin. In: Postgraduate medical journal. Band 72, Nummer 844, Februar 1996, S. 109–112, PMID 8871462. PMC 2398362 (freier Volltext).
Einzelnachweise
- Eintrag zu METHYL SALICYLATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- Eintrag zu Salicylsäureester. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Februar 2012.
- Europäisches Arzneibuch, 8. Ausgabe, Grundwerk 2014, S. 4097.
- Eintrag zu Methylsalicylat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-376.
- Eintrag zu Methyl salicylate in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 29. Mai 2021.
- R. Hänsel, O. Sticher: Pharmakognosie – Phytopharmazie. 9. Auflage, Wissenschaftliche Verlagsges.mbH, Stuttgart 2010, S. 1036.
- RÖMPP Lexikon Chemie, 10. Auflage, 1996–1999: Band 6: T – Z.
- Patent DE137585: Verfahren zur Darstellung der Alkoxymethylester der Salicylsäure. Veröffentlicht am 26. November 1902, Anmelder: Farbenfabriken, vorm. Friedr. Bayer & Co. in Elberfeld.
- Patent US740628: Alkoxyalkyliden Esters of Salicylic Acid. Veröffentlicht am 6. Oktober 1903, Erfinder: Jürgen Callsen.
- Patent US706018: Alkyloxymethyl Esters of Salicylic Acid and Process of Making Same. Veröffentlicht am 5. August 1902, Erfinder: Jürgen Callsen.
- A. Eichengrün: Ueber Aristochin, Mesotan, Helmitol und Theoein. In: Pharmazeutische Zeitung. Band 47, November 1902, S. 857–858, urn:nbn:de:gbv:084-11022408557.
- A. Eichengrün: Ueber Aristochin, Mesotan, Helmitol und Theoein (Schluss). In: Pharmazeutische Zeitung. Band 47, November 1902, S. 866–867, urn:nbn:de:gbv:084-11022408557.
- Sigrun Mittl (2021), Nachhaltig imkern mit gesunden Honigbienen, Haupt Verlag, Bern, ISBN 978-3-258-08250-9, S. 136.
- Fachinformation Trauma-Salbe kühlend Mayrhofer, Kwizda Pharma GmbH, Wien. Stand: März 2018
- Better labels urged for sports creams, USA Today, The Associated Press, Juni 2007 (engl.).
- Y.-Z. Liu, X.-Y. Li, X. Li, L. Zhang: Nitration Reaction between Methyl Salicylate and Iron(III) Nitrate and Its Regioselectivity. In: Chinese Journal of Applied Chemistry. 2010. Abstract.
- Pia Kahnberg, Choon Woo Lee, Robert H Grubbs, Olov Sterner: Alternative routes to pterulone. In: Tetrahedron. Band 58, Nr. 26, Juni 2002, S. 5203–5208, doi:10.1016/S0040-4020(02)00505-7.
- W. B. Salter, J. R. Owens, J. D. Wander: Methyl Salicylate: A Reactive Chemical Warfare Agent Surrogate to Detect Reaction with Hypochlorite. In: ACS Appl. Mater. Interfaces. 2011, 3(11), S. 4262–4267 doi:10.1021/am200929v.
- O. S. Tee, N. R. Iyengar: The bromination of salicylate anions. Evidence for the participation of the ortho carboxylate group. In: J. Org. Chem. 1985, 50(23), S. 4468–4473. doi:10.1021/jo00223a011.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Methyl salicylate, abgerufen am 26. März 2019.

