Queuosin
Queuosin (Q) ist ein seltenes Nukleosid und kommt in der tRNA von Bakterien und Eukaryoten vor.[3][4] Es besteht aus der β-D-Ribofuranose (Zucker) und dem Queuin. Es leitet sich wie das Archaeosin strukturell von Guanosin ab. Das N7-Atom des Guanins wird durch ein C7-Atom ersetzt und bildet damit das 7-Desazaguanosin, an dem weitere Substituenten angefügt werden können.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
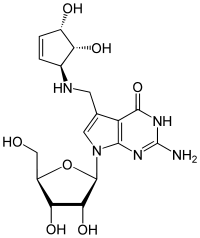 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Queuosin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C17H23N5O7 | ||||||||||||
| Kurzbeschreibung |
gelblicher Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 409,39 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt |
225–230 °C (Zersetzung)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Queuosin wurde erstmals 1968 in einer tRNA von E. coli gefunden, es findet sich im Anticodon an Position 34 und besetzt die Wobble-Position für Histidin, Asparaginsäure, Asparagin und Tyrosin.[5] Der Cyclopentenring des Queuosins ragt aus dem Anticodon heraus und behindert somit nicht die Basenpaarung mit dem Codon der mRNA. Es besteht die Möglichkeit von Wasserstoffbrückenbindungen zwischen den Hydroxygruppen des Cyclopentenrings und den Sauerstoffatomen der Ribose des Uracils an Position 33.[6] Vergleicht man die Bindungsstärken zwischen Codon und Anticodon (Guanosin bzw. Queuosin an Position 34), so ist zu beobachten, dass Guanosin seinen üblichen Partner C bevorzugt. Das Queuosin kann zwischen C und U nicht mehr unterscheiden.[7][8][9]
Literatur
- Florian Klepper: Synthese der natürlichen tRNA Nukleosidmodifikationen Queuosin und Archaeosin, Dissertation, München 2007 (PDF; 5,1 MB).
- Florian Klepper, Eva-Maria Jahn, Volker Hickmann, Thomas Carell: Synthese des tRNA-Nucleosids Queuosin unter Verwendung eines chiralen Allylazid-Intermediats; Angewandte Chemie, 2007, 119 (13), S. 2377–2379 (doi:10.1002/ange.200604579).
- Florian Klepper, Eva-Maria Jahn, Volker Hickmann, Thomas Carell: Synthesis of the Transfer-RNA Nucleoside Queuosine by Using a Chiral Allyl Azide Intermediate; Angewandte Chemie International Edition, 2007, 46 (13), S. 2325–2327 (doi:10.1002/anie.200604579).
Einzelnachweise
- John Buckingham, Keith H. Baggaley, Andrew D. Roberts, Laszlo F. Szabo: Dictionary of Alkaloids with CD-ROM. CRC Press, 2010, ISBN 978-1-4200-7770-4, S. 1632 (books.google.de).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- D. Iwata-Reuyl: Biosynthesis of the 7-deazaguanosine hypermodified nucleosides of transfer RNA; Bioorg. Chem., 2003, 31 (1), S. 24–43 (doi:10.1016/S0045-2068(02)00513-8; PMID 12697167).
- R. C. Morris, M. S. Elliott: Queuosine modification of tRNA: a case for convergent evolution; Mol. Genet. Metab., 2001, 74 (1–2), S. 147–159 (doi:10.1006/mgme.2001.3216; PMID 11592812).
- F. Harada, S. Nishimura: Possible anticodon sequences of tRNAHis, tRNAAsm, and tRNAAsp from Escherichia coli B. Universal presence of nucleoside Q in the first position of the anticondons of these transfer ribonucleic acids; Biochemistry, 1972, 11 (2), S. 301–308 (doi:10.1021/bi00752a024; PMID 4550561).
- R. C. Morris, K. G. Brown, M. S. Elliott: The Effect of Queuosine on tRNA Structure and Function; J. Biomol. Struct. Dyn., 1999, 16 (4), S. 757–774 (doi:10.1080/07391102.1999.10508291; PMID 10217448).
- F. Meier, B. Suter, H. Grosjean, G. Keith, E. Kubli: Queuosine modification of the wobble base in tRNAHis influences ‘in vivo’ decoding properties; EMBO J., 1985, 4 (3), S. 823–827 (PMC 554263 (freier Volltext); PMID 2988936).
- M. Bienz, E. Kubli: Wild-type tRNATyrG reads the TMV RNA stop codon, but Q base-modified tRNATyrQ does not; Nature, 1981, 294, S. 188–190 (doi:10.1038/294188a0).
- J. Urbonavicius, Q. Qian, J. M. Durand, T. G. Hagervall, G. R. Björk: Improvement of reading frame maintenance is a common function for several tRNA modifications; EMBO J., 2001, 20 (17), S. 4863–4873 (doi:10.1093/emboj/20.17.4863; PMC 125605 (freier Volltext); PMID 11532950).