Queuin
Queuin ist eine heterocyclische organische Verbindung. Es ist ein Derivat der Nukleinbase Guanin. Das N7-Atom des Guanins wird durch ein C7-Atom ersetzt und bildet damit das 7-Desazaguanosin, an dem ein Cyclopentenring über eine Aminomethylgruppe angefügt wurde. Es kommt als Bestandteil des Nukleosids Queuosin (Q) in der tRNA vor.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
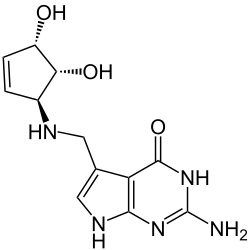 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Queuin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C12H15N5O3 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 277,28 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest (Hydrochlorid)[1] | |||||||||||||||
| Schmelzpunkt |
230–235 °C (Hydrochlorid, Zersetzung)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte und Eigenschaften
Queuine wurde erstmals im Fruchtwasser von Rindern entdeckt. Später wurde festgestellt, dass es bis auf wenige Ausnahmen im gesamten eukarylischen und eubakteriellen Reich vorkomt. Queuine ist insofern ungewöhnlich, als es im Gegensatz zu den meisten modifizierten Nukleotiden, die durch Modifikationen der genetisch kodierten Nukleotide entstehen, durch Transglykosylierung in die RNA eingebaut wird. Die Modifikation von Queuine unterscheidet sich je nach Art des betrachteten Organismus. Eukaryonten bauen Queuine in die RNA ein, während Eubakterien preQ1 einbauen, das dann zu Queuine modifiziert wird. Es ist seit langem bekannt, dass Queuine in der Wobble-Position von vier tRNAs vorkommt: Asparaginsäure, Asparagin, Histidin und Tyrosin. Spätere In-vitro-Studien mit der Transglykosylase von Escherichia coli haben jedoch gezeigt, dass Queuine auch in anderen RNA-Arten vorkommen kann.[3][4]
Gewinnung und Darstellung
Es gibt mindestens vier bekannte Synthesen von Queuin. Die Synthese von Kondo et al. erfolgt über eine Schiffsche Base zwischen einem geschützten Pyrrolopyrimidinaldehyd und einem geschützten Amin der Queuinseitenkette in insgesamt 19 Schritten. Die Synthese von Akimoto et al. ist wesentlich kürzer und erfolgt über eine Mannich-Reaktion, bei der die geschützte Seitenkette des Queuins regioselektiv in die C-5-Position eines Pyrrolopyrimidin-Vorläufers eingebaut wird. Ihr größter Nachteil ist, dass mehrere Äquivalente der Seitenkette in einer Schlüsselaustauschreaktion benötigt werden. Bei der Synthese von Barnett und Grubb wird das Molekül auf andere Weise getrennt, und zwar durch eine Mitsunobu-Schlüsselreaktion zur Einführung der Cyclopentenylamin-Seitenkette und eine anschließende Cyclokondensationsreaktion zum Aufbau des heterocyclischen Kernstücks. Dieses Verfahren ist zwar relativ einfach und effizient, erfordert aber 11 lineare Schritte. Eine außergewöhnlich kurze und ertragreiche Synthese von Queuine aus leicht verfügbaren Vorläufern ist ebenfalls bekannt. Es nutzt eine Strategie, bei der leicht zugängliche Seitenkettenamin- und Kernheterozyklenteile über einen reduktiven Aminierungsschritt kondensiert werden, gefolgt von einem globalen Deprotektionsschritt.[3]
Verwendung
Queuin wurde für als Inhaltsstoff von Kosmetika zur Verzögerung der Hautalterung patentiert.[5]
Literatur
- Walter R. Farkas: Queuine, The Q-Containing tRNAs and the Enzymes Responsible for Their Formation; Nucleosides, Nucleotides and Nucleic Acids, 1983, 2 (1), S. 1–20 (doi:10.1080/07328318308078845).
- Hiroshi Akimoto, Eiko Imamiya, Takenori Hitaka, Hiroaki Nomura, Susumu Nishimura: Synthesis of Queuine, the Base of Naturally Occurring Hypermodified Nucleoside (Queuosine), and Its Analogues; J. Chem. Soc., Perkin Trans. 1, 1988, S. 1637–1644 (doi:10.1039/P19880001637).
- Charles J. Barnett, Lana M. Grubb: Total Synthesis of Q-Base (Queuine); Tetrahedron, 2000, 56 (47), S. 9221–9225 (doi:10.1016/S0040-4020(00)00895-4).
- Florian Klepper: Synthese der natürlichen tRNA Nukleosidmodifikationen Queuosin und Archaeosin, Dissertation, München 2007 (PDF; 5,1 MB), S. 25–28.
- Allen F. Brooks, George A. Garcia, H. D. Hollis Showalter: A Short, Concise Synthesis of Queuine; Tetrahedron Letters, 2010, 51 (32), S. 4163–4165 (doi:10.1016/j.tetlet.2010.06.008; PDF).
Einzelnachweise
- John Buckingham, Keith H. Baggaley, Andrew D. Roberts, Laszlo F. Szabo: Dictionary of Alkaloids with CD-ROM. CRC Press, 2010, ISBN 978-1-4200-7770-4, S. 1632 (books.google.de).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Allen F. Brooks, George A. Garcia, H. D. Hollis Showalter: A short, concise synthesis of queuine. In: Tetrahedron Letters. Band 51, Nr. 32, 2010, ISSN 0040-4039, S. 4163–4165, doi:10.1016/j.tetlet.2010.06.008 (sciencedirect.com).
- Jon R. Katze, Brenda Basile, James A. McCloskey: Queuine, a Modified Base Incorporated Posttranscriptionally into Eukaryotic Transfer RNA: Wide Distribution in Nature. In: Science. 1982, doi:10.1126/science.7063869 (science.org).
- Google Patents: US9610236B2 - Cosmetic use of Queuine - Google Patents, abgerufen am 25. Januar 2022
Weblinks
- Eintrag zu Queuine in der Human Metabolome Database (HMDB), abgerufen am 12. Juni 2019.