Präsynaptische Rezeptoren
Präsynaptische Rezeptoren sind Rezeptoren an den präsynaptischen Endigungen von Nervenzellen. Botenstoffe, die hier andocken, modifizieren die Funktionen der präsynaptischen Endigungen, vor allem die Freisetzung von Neurotransmittern.
Geschichte
Die chemische Natur der Informationsübertragung in Synapsen wurde 1921 von Otto Loewi entdeckt.[1] Man nahm seither lange – oft unausgesprochen – an, für diese Informationsübertragung bedürfe es nur des präsynaptischen Neurotransmitters und der postsynaptischen Rezeptoren an den innervierten Zellen, die den Neurotransmitter erkennen und die postsynaptische Zellantwort einleiten. Die präsynaptischen Endigungen sollten danach ihren Transmitter beim Eintreffen von Aktionspotentialen ohne jede weitere Modulation freisetzen, allerdings abhängig von der Frequenz der Aktionspotentiale.
Jedoch gab es schon 1924 einen Hinweis, dass auch präsynaptische Endigungen Rezeptoren besitzen. Nikotin setzte nämlich in isolierten Herzen von Kaninchen Noradrenalin frei, den Transmitter der postganglionären sympathischen Neurone des Herzens, und zwar offenbar durch eine direkte Wirkung auf die präsynaptischen Endigungen.[2] So wurde klar, dass die Endigungen Nikotinrezeptoren besaßen, eine der beiden großen Gruppen von Rezeptoren für den Botenstoff Acetylcholin. Jedoch sind diese Rezeptoren physiologisch funktionslos. Zwar kommt Acetylcholin als Transmitter des Parasympathikus im Herzen vor, jedoch sind die aus dem Parasympathikus freigesetzten Mengen zu gering, um die präsynaptischen Nikotinrezeptoren zu aktivieren.
Die erste Entdeckung eines physiologisch relevanten präsynaptischen Rezeptors gelang ebenfalls bei Experimenten mit isolierten Herzen von Kaninchen. Ruth Lindmar, Konrad Löffelholz und Erich Muscholl vom Pharmakologischen Institut der Universität Mainz beobachteten, dass Acetylcholin und andere Substanzen, die als Agonisten an der anderen großen Gruppe von Rezeptoren für Acetylcholin wirken, den Muskarinrezeptoren, in Kaninchenherzen die durch sympathische Nervenaktivität (also durch Aktionspotentiale) ausgelöste Freisetzung von Noradrenalin hemmten, und dass diese Hemmung sich durch Antagonisten an Muskarinrezeptoren wie das Atropin aufheben ließ. Die präsynaptischen Endigungen der postganglionären sympathischen Neurone des Herzens besaßen also außer den freisetzungsfördernden Nikotinrezeptoren auch freisetzungshemmende Muskarinrezeptoren (Bild). Obendrein dienten die letzteren im Gegensatz zu den ersteren einer physiologischen Funktion. Sie wurden nämlich auch durch die kleinen Mengen an Acetylcholin aktiviert, die aus dem Parasympathikus im Herzen freigesetzt wurden.[3][4]
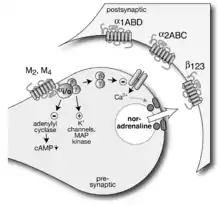
Präsynaptische Autorezeptoren
Kurz nach der Auffindung der präsynaptischen Muskarinrezeptoren an postganglionären sympathischen Neuronen entdeckte man, dass viele präsynaptische Endigungen auch Rezeptoren für ihren eigenen Transmitter besitzen. Diese präsynaptischen Autorezeptoren dienen einer negativen Rückkopplung. Durch bereits freigesetzte Transmitter wird – bei Erreichen einer bestimmten Verteilungsdichte – eine weitere Freisetzung gehemmt.
Präsynaptische Rezeptoren an Nervenzellen mit Noradrenalin als Transmitter
Sie sind die am besten bekannten präsynaptischen Rezeptoren. Nervenzellen mit Noradrenalin – kurz Noradrenalin-Neurone genannt – kommen einerseits im Gehirn vor, vor allem im Locus caeruleus, andererseits in der Körperperipherie, dort als Transmitter der postganglionären sympathischen Neurone. Die Tabelle gibt eine Übersicht. Die erste Zeile enthält die präsynaptischen α2-Autorezeptoren, über die Noradrenalin seine eigene Freisetzung hemmt, die siebente die erstentdeckten Muskarinrezeptoren. Im Übrigen kann die Freisetzung von Noradrenalin sowohl durch Transmitter aus benachbarten synaptischen Endigungen wie Acetylcholin, Serotonin und endogene Opioide als auch durch Hormone wie Adrenalin, ACTH und Angiotensin II und durch Gewebshormone wie Adenosin, Bradykinin und Prostaglandine moduliert werden.[6] Man nennt die Vielzahl der Nicht-Autorezeptoren manchmal präsynaptische „Heterorezeptoren“.
| Botenstoff | Präsynaptischer Rezeptor | Änderung der Noradrenalinfreisetzung |
|---|---|---|
| Noradrenalin, Adrenalin | α2-Adrenozeptor (Autorezeptor) | ↓ |
| Adrenalin | β2-Adrenozeptor | ↑ |
| Dopamin | D2-Rezeptor | ↓ |
| Histamin | H3-Rezeptor | ↓ |
| Serotonin | 5-HT1-Rezeptor | ↓ |
| Acetylcholin | Nikotinrezeptor | ↑ |
| Acetylcholin | Muskarin-M2- und M4-Rezeptor | ↓ |
| γ-Aminobuttersäure | GABAB-Rezeptor | ↓ |
| Adenosin | Adenosin-A1-Rezeptor | ↓ |
| Adenosin | Adenosin-A2A-Rezeptor | ↑ |
| Adenosintriphosphat | P2Y12 und andere P2Y-Rezeptoren | ↓ |
| Adenosintriphosphat | P2X2 | ↑ |
| Endogene Opioide | Opioid μ-, δ-, κ-Rezeptor | ↓ |
| Nociceptin | ORL1-Rezeptor (opioid receptor-like-1 receptor) | ↓ |
| Neuropeptid Y | NPY2-Rezeptor | ↓ |
| Adrenocorticotropin | Melanocortin-MC2-Rezeptor | ↑ |
| Angiotensin II | AT1-Rezeptor | ↑ |
| Bradykinin | B2-Rezeptor | ↑ |
| Endogene Cannabinoide | CB1-Rezeptor | ↓ |
| Prostaglandine | Prostaglandin EP3-Rezeptor | ↓ |
Alle diese präsynaptischen Rezeptoren modulieren primär die Funktion von Synapsen. Einige sind darüber hinaus allgemein medizinisch wichtig. Die Hemmung der Freisetzung von Noradrenalin durch die α2-Autorezeptoren schützt vor Herz-Kreislaufkrankheiten.[7] Die Steigerung der Freisetzung durch Adrenalin über β2-Adrenozeptoren kann zur Entstehung eines Bluthochdrucks beitragen. Das Gleiche gilt für die Steigerung der Freisetzung durch Angiotensin. Die Hemmung der Freisetzung im Gehirn durch Opioide ist vielleicht an deren analgetischer Wirkung beteiligt.
Präsynaptische Rezeptoren an Nervenzellen mit anderen Transmittern
Fast alle Nervenzellen besitzen präsynaptische Rezeptoren.[8][9][10][11] Unter anderen die folgenden vier sind physiologisch und medizinisch wichtig.
- Der Sympathikus hemmt die Peristaltik des Darms. Dies geschieht zum Teil durch eine Hemmung der Freisetzung des Parasympathikus-Transmitters Acetylcholin. Das Noradrenalin des Sympathikus wirkt dabei auf präsynaptische α2-Adrenozeptoren an den cholinergen Neuronen.
- Die Abhängigkeit erzeugende Wirkung des Nikotins beruht wesentlich auf einer Freisetzung von Dopamin aus präsynaptischen Endigungen im Nucleus accumbens.[13] Die Nikotinrezeptoren entsprechen den oben erwähnten Nikotinrezeptoren auf den Endigungen der postganglionären sympathischen Neurone im Herzen. Das zur Raucherentwöhnung benutzte Vareniclin greift an den präsynaptischen Nikotinrezeptoren im Nucleus accumbens an.
- Opioide hemmen über präsynaptische Rezeptoren außer der Freisetzung von Noradrenalin im Gehirn (Tabelle) auch die Freisetzung von Glutaminsäure und Substanz P im Rückenmark. Beide sind Transmitter von schmerzleitenden Neuronen. Dies ist eine zweite Komponente der analgetischen Wirkung der Opioide.
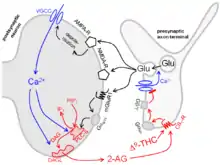
- Die meisten CB1-Rezeptoren für Δ9-Tetrahydrocannabinol und andere Cannabinoide sind auf präsynaptischen Endigungen lokalisiert (siehe auch Tabelle). Sie hemmen dort die Transmitterfreisetzung und sind hauptverantwortlich für die vielen Cannabinoidwirkungen wie Sedierung, Analgesie und Ataxie. Das Bild zeigt einen CB1-Rezeptor auf einer synaptischen Endigung mit Glutaminsäure als Transmitter. Er kann nicht nur durch Pflanzeninhaltsstoffe wie Δ9-Tetrahydrocannabinol (Δ9-THC) aktiviert werden, sondern auch durch endogene Cannabinoide wie das 2-Arachidonylglycerol (2-AG). Es resultiert die im Bild gezeigte retrograde synaptische Übertragung:
Freigesetzte Glutaminsäure (Glu) aktiviert die postsynaptischen Glutamatrezeptoren NMDA-R, AMPA-R und mGluR1. Dadurch gelangt Calcium ins Zytoplasma des postsynaptischen Neurons. Calcium aktiviert das Enzym Diacylglycerol-Lipase (DAGL), das die Entstehung von 2-AG katalysiert. 2-AG schließlich wirkt auf den präsynaptischen CB1-Rezeptor und hemmt die weitere Freisetzung von Glutaminsäure. Man schreibt dieser retrograden synaptischen Übertragung eine Rolle für Lernen und Gedächtnis zu.
Jedoch sollte bei der Suche nach physiologischer und medizinischer Bedeutung die frühe Skepsis nicht vergessen werden (aus dem Englischen): „Schon die Vielzahl präsynaptischer Rezeptoren lässt vermuten, dass einige physiologisch stumm sind. … Sie mögen Spuren der Evolution sein, die fortbestehen, weil sie uns nicht schaden.“[14]
Mechanismen der präsynaptischen Modulation
Der Weg vom Eintreffen eines Aktionspotentials in einer präsynaptischen Endigung bis zur Transmitterfreisetzung durch Exocytose ist vielschrittig. Ein wichtiger Schritt ist ein Einstrom von Calcium durch präsynaptische Calciumkanäle. Wo greifen die präsynaptischen Rezeptoren an?
Einige sind Botenstoff-aktivierte Ionenkanäle. Hierher gehören die Nikotinrezeptoren und die P2X-Rezeptoren. Durch den Botenstoff aktiviert, öffnen sie sich (erhöhen ihre „Offenwahrscheinlichkeit“), Ionen strömen hinein oder heraus, und die Freisetzung ändert sich.
Die meisten präsynaptischen Rezeptoren sind aber G-Protein-gekoppelte Rezeptoren. Hierher gehören die Muskarinrezeptoren der Noradrenalin-Axonendigung im oberen und die CB1-Rezeptoren der Glutaminsäure-Axonendigung im unteren Bild. Sie koppeln an G-Proteine der Gi/o-Familie. Aus diesen wird dann die βγ-Untereinheit frei, diffundiert zu benachbarten Calciumkanälen, vermindert deren Offenwahrscheinlichkeit und hemmt so die Exocytose. Dieser Weg ist der wichtigste überhaupt. Auch die präsynaptischen Opioidrezeptoren nutzen ihn.
Es gibt aber weitere Mechanismen. Die Peptide Angiotensin II und Bradykinin steigern die Freisetzung von Noradrenalin. Ihre Rezeptoren (siehe Tabelle) koppeln an das G-Protein Gq. Dessen α-Untereinheit erhöht über mehrere Schritte die Offenwahrscheinlichkeit benachbarter Calciumkanäle – das Gegenteil der Wirkung der βγ-Untereinheit von Gi/o.
Schließlich gibt es Rezeptor-Reaktionskaskaden, die distal vom Calciumeinstrom, zwischen dem Calciumeinstrom und der Exocytose, münden.[15]
Einzelnachweise
- O. Loewi: Über humorale Übertragung der Herznervenwirkung. In: Pflügers Archiv. 193, 1921, S. 201–213.
- Walter E. Dixon: Nicotin, Coniin, Piperidin, Lupetidin, Cytisin, Lobelin, Spartein, Gelsemin. In: A. Heffter (Hrsg.): Handbuch der experimentellen Pharmakologie. Band 2, Springer-Verlag, Berlin 1924, S. 656–736.
- R. Lindmar, K. Löffelholz, E. Muscholl: A muscarinic mechanism inhibiting the release of noradrenaline from peripheral adrenergic nerve fibres by nicotinic agents. In: British Journal of Pharmacology. 32, 1968, S. 280–294.
- K. Löffelholz, E. Muscholl: Inhibition by parasympathetic nerve stimulation of the release of the adrenergic transmitter. In: Naunyn-Schmiedebergs Archiv für Pharmakologie. 267, 1970, S. 181–184.
- Modifiziert nach Ralf Gilsbach, Lutz Hein: Presynaptic metabotropic receptors for acetylcholine and adrenaline/noradrenaline. In: Thomas C. Südhof, Klaus Starke (Hrsg.): Pharmacology of Neurotransmitter Release. (= Handbook of Experimental Pharmacology. 184). Springer-Verlag, Berlin 2008, ISBN 978-3-540-69246-1, S. 261–288.
- K. Starke: Regulation of noradrenaline release by presynaptic receptor systems. In: Reviews of Physiology, Biochemistry and Pharmacology. 77, 1977, S. 1–124.
- Ralf Gilsbach, Johanna Schneider, Achim Lother, Stefanie Schickinger, Jost Leemhuis, Lutz Hein: Sympathetic α2-adrenoceptors prevent cardiac hypertrophy and fibrosis in mice at baseline but not after chronic pressure overload. In: Cardiovascular Research. 86, 2010, S. 432–442.
- S. Z. Langer, K. Starke, M. L. Dubocovich (Hrsg.): Presynaptic Receptors. Pergamon Press, Oxford 1979, ISBN 0-08-023190-X.
- Thomas V. Dunwiddie, David M. Lovinger (Hrsg.): Presynaptic Receptors in the Mammalian Brain. Birkhäuser, Boston 1993, ISBN 3-7643-3651-X.
- H. Fuder, E. Muscholl: Heteroreceptor-mediated modulation of noradrenaline and acetylcholine release from peripheral nerves. In: Reviews of Physiology, Biochemistry and Pharmacology. 126, 1995, S. 265–412.
- Thomas C. Südhof, Klaus Starke (Hrsg.): Pharmacology of Neurotransmitter Release. (= Handbook of Experimental Pharmacology. 184). Springer-Verlag, Berlin 2008, ISBN 978-3-540-74804-5.
- Modifiziert nach Bela Szabo: Funktion des neuronalen Cannabinoidrezeptors. In: Biospektrum. im Druck
- Jacques Barik, Susan Wonnacott: Molecular and cellular mechanisms of action of nicotine in the CNS. In: Jack E. Henningfield, Edythe D. London, Sakire Pogun (Hrsg.): Nicotine Psychopharmacology. (= Handbook of Experimental Pharmacology. 192). Springer-Verlag, Berlin 2009, ISBN 978-3-540-69246-1, S. 173–207.
- K. Starke: Presynaptic receptors. In: Annual Review of Pharmacology and Toxicology. 21, 1981, S. 7–30.
- A. David Brown, Talvinder S. Sihra: Presynaptic signalling by heterotrimeric G-proteins. In: Thomas C. Südhof, Klaus Starke (Hrsg.): Pharmacology of Neurotransmitter Release. (= Handbook of Experimental Pharmacology. 184). Springer-Verlag, Berlin 2008, ISBN 978-3-540-69246-1, S. 207–260.