Monochlorsilan
Monochlorsilan ist ein hochentzündliches, korrosives und giftiges Gas, welches schwerer als Luft ist.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
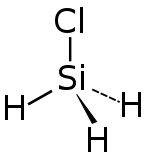 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Monochlorsilan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | SiH3Cl | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 66,56 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
−118 °C[3] | |||||||||||||||
| Siedepunkt |
−30 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
reagiert heftig mit Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung
Monochlorsilan kann durch Chlorierung von Monosilan mit Chlorwasserstoff in Gegenwart von Aluminiumchlorid als Katalysator bei erhöhter Temperatur hergestellt werden.[4] Neben Chlorsilan entsteht im Verhältnis 4:1 als Nebenprodukt Dichlorsilan.
Auch die Herstellung aus Siliciumtetrachlorid und Lithiumborhydrid ist möglich.[5]
Eigenschaften
Monochlorsilan ist ein farbloses Gas, bei dessen Hydrolyse primär Silanol (Hydroxosilan) entsteht, das jedoch spontan zu Disiloxan kondensiert.[6]
Einzelnachweise
- Sicherheitsdatenblatt MONOCHLOROSILANE (Memento vom 19. Dezember 2015 im Internet Archive) bei REC Silicon (PDF; 210 kB).
- Stock, A.; Somieski, C.: Siliciumwasserstoffe VI.: Chlorierung und Methylierung des Monosilans in Chem. Ber. 52 (1919) 695–724, doi:10.1002/cber.19190520410.
- Eintrag zu Silane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. April 2013.
- Alfred Stock, Carl Somieski: Siliciumwasserstoffe VI.: Chlorierung und Methylierung des Monosilans. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). Band 52, Nr. 4, 12. April 1919, S. 695, doi:10.1002/cber.19190520410.
- Walter Glasmann: Über die Siliciumsuboxyde Si2O3 und SiO: Zur Darst. u. Hydrolyse d. Chlorsilane HSiCl3 u. H2SiCl2 u. zur Pyrolyse ihrer Hydrolysate. 1962, OCLC 163333765, S. 29 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ralf Steudel: Chemie der Nichtmetalle: Von Struktur und Bindung zur Anwendung. Walter de Gruyter, 2008, ISBN 978-3-11-021128-3, S. 288 (eingeschränkte Vorschau in der Google-Buchsuche).
- Barry Arkles: Silanes. (PDF) Reprint from Kirk-Othmer Encyclopedia of Chemical Technology, Forth Edition, Volume 22, Page 38–69. In: Gelest. S. 39, abgerufen am 10. Dezember 2016 (englisch).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.




