Halogensilane
Als Halogensilane bezeichnet man chemische Verbindungen aus der Gruppe der Silane, in welchen an das Siliciumatom ein oder mehrere Halogenatome gebunden sind. Enthält das Molekül zusätzlich einen organischen Rest so spricht man von Organohalogensilanen.
Geschichte
Die Darstellung von Tetrafluorsilan SiF4 durch Umsetzung von Kieselerde mit Flusssäure wurde bereits 1811 beschrieben.[1] 1823 berichtete Jöns Jacob Berzelius über die Herstellung von Tetrachlorsilan durch Umsetzung von Silicium mit Chlorgas.[2] Später beschreibt er die Darstellung in seinem Lehrbuch wie folgt:[3]
„Wird Kiesel in einem Strome von Chlorgas erhitzt, so entzündet es sich und verbrennt. Wird das über dem Kiesel gegangene Gas in eine abgekühlte Vorlage geleitet, so wird Chlorkiesel als eine gelbliche Flüssigkeit condensirt, deren Farbe jedoch von absorbirtem Chlorgase herzurühren scheint. Mit geringeren Umständen und in Menge erhält man diese Verbindung, wenn man fein zertheilte Kieselsäure mit Kohlenpulver und Oel zu einem steifen Teig anmacht, die Masse in einem verdeckten Tiegel verkohlt und darauf in kleine Stücke zerbricht, welche man in eine Porcellanröhre legt, durch die man aus einem damit verbundenem Entwickelungsapparat durch Chlorcalcium getrocknetes Chlor leitet. Während des Durchströmens des Chlorgases wird die Porcellanröhre zum Glühen erhitzt, die Kohle vereinigt sich alsdann mit dem Sauerstoff der Kieselsäure zu Kohlenoxyd und das Chlor mit dem Kiesel zu Chlorkiesel.“
1857, im selben Jahr als er zum ersten Mal Monosilan synthetisierte, stellte Friedrich Wöhler durch Umsetzung von kristallinem Silicium unterhalb der Rotglut mit Chlorwasserstoffgas die ersten teilhalogenierten Silane her.[4] Diesen gab Wöhler zunächst die Formeln Si2X3+2 HX (mit X = Cl, Br, I). Erst später wurden durch Charles Friedel und Albert Ladenburg die Substanzen richtig als Trichlorsilan (Siliciumchloroform), Tribromsilan und Triiodsilan identifiziert.[5][6]
Herstellung
Die Herstellung von Halogensilanen kann durch direkte Umsetzung von Silicium oder Ferrosilicium mit Halogenwasserstoff oder durch Umsetzung von Monosilan mit Halogendonatoren, wie Silber(I)-chlorid oder Halogenwasserstoff erfolgen.[5][7][8][9]
Auch die Reaktion von Phenylsilanen mit Halogenwasserstoffen ist möglich:[10]
Bei höheren Temperaturen lassen sich Halogensilane in Gegenwart von Silicium direkt mit Wasserstoff reduzieren.[10]
Auch die Darstellung aus anderen Halogensilanen z. B. durch Umsetzung mit Antimon(III)-fluorid ist möglich.[11][12]
Die direkte Umsetzung von Monosilan mit Chlor oder Brom bei tiefen Temperaturen ergibt ein Gemisch verschiedener Halogensilane vom Typ SiHnX4−y (mit n = 1, 2, 3); bei Raumtemperatur ist die Reaktion dagegen explosionsartig.[13]
Die Tetrahalogensilane werden, wie bereits durch Berzelius beschrieben, üblicherweise durch die direkte Reaktion von Silicium oder Ferrosilicium mit Halogenen gewonnen:[3] Tetrafluorsilan kann auch ohne den Umweg über elementares Silicium direkt durch Reaktion von Siliciumdioxid mit Fluorwasserstoff hergestellt werden:
Dimere oder polymere Halogensilane sind analog zu den Silanen mit Hilfe einer elektrischen Entladung zugänglich.[10]
Organohalogensilane werden großtechnisch über die Müller-Rochow-Synthese gewonnen:
Struktur und Eigenschaften
Die einkernigen Halogensilane sind Derivate des Monosilans bei denen ein oder mehrere Wasserstoffatome durch ein Halogenatom ersetzt sind. Analog zu den Silanen und den Halogenalkanen existieren auch bei den Halogensilanen mehrkernige Verbindungen, wie Hexachlordisilan oder Octachlortrisilan. Die Stabilität der Silicium-Halogen-Bindung nimmt von Iod, über Brom und Chlor zum Fluor zu und ist deutlich stärker als die Silicium-Wasserstoff-Bindung. Entsprechend sind gegenüber den Stammverbindungen mehrkernige Silane mit Halogenen deutlich stabiler.[14] Die kurzkettigen Perchlorsilane von Typ SinCl2n+2 wurden bereits früh durch Überleiten von Tetrachlorsilan über Silicium oder Ferrosilicium hergestellt. Die höheren Vertreter werden dagegen durch Thermolyse von Tetrachlorsilan und anschließender Fraktionierung gewonnen. Als höchstes Glied der Kette konnte dabei, neben einem zähen, dehnbaren, hochreaktiven Feststoff mit der Zusammensetzung Si25Cl52, das flüssige Si10Cl22 und, in einer Wasserstoffatmosphäre, ebenfalls flüssiges Si10Cl20H2 isoliert werden.[15][16] Aus letzterem können durch weitere Thermolyse noch höhermolekulare Polymere synthetisiert werden, darunter ein perchloriertes Siliciumanalogon zum Dekalin mit der Formel Si10Cl18 und letztendlich unter Abspaltung von Hexachlordisilan, Octachlortrisilan und Decachlortetrasilan ein polymeres Siliciumchlorid mit der Formel (SiCl)∞.[17][18] Auch cyclische Halogensilane von Typ Si4X8, Si5X10 und Si6X12 (X = Cl, Br) sind bekannt.[19][20]
Physikalische Eigenschaften
Die meisten einkernigen Halogensilane sind bei Raumtemperatur gasförmig oder flüssig, nur Tetraiodsilan liegt als Feststoff vor. Die Schmelz- und Siedepunkte liegen nahe denen der korrespondierenden Kohlenstoff-Homologen.
| Schmelz- und Siedepunkte | |||||
|---|---|---|---|---|---|
| SiH4 | SiH3X | SiH2X2 | SiHX3 | SiX4 | |
| Monosilan −185 °C −112 °C | Monofluorsilan −98,6 °C (Sublimation) | Difluorsilan −122 °C −77,8 °C | Trifluorsilan −131 °C −95 °C | Tetrafluorsilan −95,2 °C (Sublimation) | |
| Monochlorsilan −118 °C −30 °C | Dichlorsilan −122,0 °C 8,4 °C | Trichlorsilan −134 °C 32 °C | Tetrachlorsilan −70 °C 57 °C | ||
| Monobromsilan −94 °C 1,9 °C | Dibromsilan −70,1 °C 66 °C | Tribromsilan −73,5 °C 111,8 °C | Tetrabromsilan 5 °C 154 °C | ||
| Monoiodsilan −56,4 °C 45,4 °C | Diiodsilan −1 °C 150 °C | Triiodsilan 8 °C 220 °C (Zers.) | Tetraiodsilan 120,5 °C 287,4 °C | ||
Chemische Eigenschaften
Halogensilane sind reaktive, meist entzündbare und hydrolyseempfindliche Substanzen. Viele Halogensilane sind thermisch instabil und zersetzen sich beim Erhitzen in ihre Elemente.[21] Sie sind aber oft stabiler als die korrespondierenden Silane: so zersetzen sich Dichlorsilan bei 1000 – 1150 °C, Trichlorsilan bei >1150 °C und Tribromsilan bei 600 – 800 °C, während Monosilan bereits bei 500 °C zerfällt.[10] In Gegenwart von Feuchtigkeit oder Wasser reagieren Halogensilane mehr oder weniger heftig unter Freisetzung der korrespondierenden Halogenwasserstoffsäuren. Die gebildeten Hydroxysilane (Silanole) sind in der Regel nicht stabil und dimerisieren oder polymerisieren unter Wasserabspaltung. So dimerisiert Hydroxysilan unter Bildung von Disiloxan:[22]
Verwendung
Als Siliciumquelle
Aufgrund ihrer thermischen Instabilität werden Halogensilane als Quelle für hochreines Silicium in der Halbleitertechnik bei der chemischen Gasphasenabscheidung und bei der Solarzellenproduktion genutzt.[23]
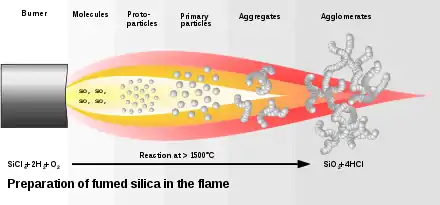
Elementares Silicium wird gereinigt, indem es zuerst in Tetrachlorsilan oder andere leicht flüchtige Halogensilane überführt und das Produkt durch Destillation von anderen Verunreinigungen abgetrennt wird. Difluorsilan wird zur Herstellung von Siliciumnitridfilmen eingesetzt.[24] Bei der Verbrennung von Tetrachlorsilan in einer Wasserstoffflamme entsteht Pyrogene Kieselsäure.
Als Vorstufe bei der Siloxan- und Silikonherstellung
Organohalogensilane sind die Vorstufen bei der technischen Herstellung von Siloxanen und Silikonen. So polymerisiert Dimethylsilandiol, welches durch Hydrolyse von Dichlordimethylsilan gewonnen wird, zu Polydimethylsiloxan.
Einzelnachweise
- Joseph-Louis Gay-Lussac, Louis Jacques Thénard: Recherches physico-chimiques, faites sur la pile; sur la préparation chimique et les propriétés du potassium et du sodium; sur la décomposition de l'acide boracique; sur les acides fluorique; muriatique et muriatique oxigéné; sur l'action chimique de la lumière; sur l'analyse végétale et animale; etc. Hrsg.: Deterville. Band 2, 1811, S. 88 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gustav Rauter: Ueber das Siliciumtetrachlorid. In: Justus Liebig's Annalen der Chemie. Band 270, Nr. 1-2, 1892, S. 235–266, doi:10.1002/jlac.18922700114.
- Jöns Jacob Berzelius: Chlorkiesel. In: Lehrbuch der Chemie, 5. Auflage. Band 1. Arnold-Verlag, Dresden 1856, S. 325–326 (digitale-sammlungen.de).
- H. Buff, F. Wöhler: Ueber neue Verbindungen des Siliciums. In: Annalen der Chemie und Pharmacie. Band 104, Nr. 1, 1857, S. 94–109, doi:10.1002/jlac.18571040108.
- C. Friedel, A. Ladenburg: Ueber das Siliciumchloroform und dessen Derivate. In: Annalen der Chemie und Pharmacie. Band 143, Nr. 1, 1867, S. 118–128, doi:10.1002/jlac.18671430112.
- C. Friedel: Ueber das Siliciumjodid und das Siliciumjodoform;. In: Annalen der Chemie und Pharmacie. Band 149, Nr. 1, 1869, S. 96–101, doi:10.1002/jlac.18691490113.
- Alfred Stock, Carl Somieski: Siliciumwasserstoffe. V: Über die Zersetzung der Siliciumwasserstoffe durch Wasser. Die Einwirkung von Bromwasserstoff auf Monosilan. In: Berichte der deutschen chemischen Gesellschaft. Band 51, Nr. 1, Januar 1918, S. 989–996, doi:10.1002/cber.191805101120.
- Alfred Stock, Carl Somieski: Siliciumwasserstoffe VI.: Chlorierung und Methylierung des Monosilans. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). Band 52, Nr. 4, 12. April 1919, S. 695–724, doi:10.1002/cber.19190520410.
- Alfred Stock, Karl Somieski: Siliciumwasserstoffe, VIII: Halogen-Abkömmlinge des Disilans, Si2H6, und ihre Hydrolyse. In: Berichte der deutschen chemischen Gesellschaft. Band 53, Nr. 5, 15. Mai 1920, S. 759–769, doi:10.1002/cber.19200530511.
- Barry Arkles: Silanes. (PDF) Reprint from Kirk-Othmer Encyclopedia of Chemical Technology, Forth Edition, Volume 22, S. 38–69. In: Gelest. S. 39, abgerufen am 10. Dezember 2016 (englisch).
- C. C. Addison: Inorganic Chemistry of the Main-Group Elements. Royal Society of Chemistry, 1973, ISBN 978-0-85186-752-6, S. 188 (eingeschränkte Vorschau in der Google-Buchsuche).
- Harold Simmons Booth, Carl F. winehart: The Fluorochlorosilanes. In: Journal of the American Chemical Society. Band 57, Nr. 7, Juli 1935, S. 1333–1337, doi:10.1021/ja01310a050.
- Alfred Stock, Carl Somieski: Siliciumwasserstoffe. II: Die Bromierung des Monosilans SiH4. Über SiH3Br und SiH2Br2. In: Berichte der deutschen chemischen Gesellschaft. Band 50, Nr. 2, Juli 1917, S. 1739–1754, doi:10.1002/cber.19170500282.
- Alfred Stock: Zur Nomenklatur der Silicium-verbindungen. In: Berichte der deutschen chemischen Gesellschaft. Band 50, Nr. 1, Januar 1917, S. 170–182, doi:10.1002/cber.19170500127.
- Robert Schwarz, Christine Danders: Einige neue Halogenide des Siliciums, VII. Mitteilung. In: Chemische Berichte. Band 80, Nr. 5, September 1947, S. 444–448, doi:10.1002/cber.19470800513.
- Robert Schwarz: Neuartige Verbindungen des Siliciums. In: Angewandte Chemie. Band 51, Nr. 22, 4. Juni 1938, S. 328–331, doi:10.1002/ange.19380512205.
- R. Schwarz: Die Chemie des Siliciums. In: Angewandte Chemie. Band 67, Nr. 4, 21. Februar 1955, S. 117–123, doi:10.1002/ange.19550670402.
- Robert Schwarz, Alfred Köster: Einige neue Halogenide des Siliciums. VIII. Über ringförmig gebaute Siliciumchloride. In: Zeitschrift für anorganische und allgemeine Chemie. Band 270, Nr. 1-4, Oktober 1952, S. 2–15, doi:10.1002/zaac.19522700103.
- Edwin Hengge, Dieter Wolfer: Boracyclopentasilan, ein neuer Typ heterocyclischer Silane. In: Angewandte Chemie. Band 85, Nr. 7, April 1973, S. 304, doi:10.1002/ange.19730850708.
- E. Hengge, D. Kovar: Darstellung und Charakterisierung eines neuen cyclischen Siliciumchlorides Si4Cl8. In: Zeitschrift für anorganische und allgemeine Chemie. Band 458, Nr. 1, November 1979, S. 163–167, doi:10.1002/zaac.19794580122.
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 676.
- Alfred Stock, Carl Somieski, Robert Wintgen: Siliciumwasserstoffe. III: Disiloxan, (SiH3)2O; zur Kenntnis des Tetrachlor-monosilans, SiCl4, und des Hexachlor-disiloxans, (SiCl3)2O. In: Berichte der deutschen chemischen Gesellschaft. Band 50, Nr. 2, Juli 1917, S. 1754–1764, doi:10.1002/cber.19170500283.
- Akihisa Matsuda, Kiyoshi Yagii, Takao Kaga, Kazunobu Tanaka: Glow-Discharge Deposition of Amorphous Silicon from SiH3F. In: Japanese Journal of Applied Physics. 23, 1984, S. L576, doi:10.1143/JJAP.23.L576.
- Nobuaki Watanabe, Mamoru Yoshida, Yi-Chao Jiang, Tutomu Nomoto, Ichimatsu Abiko: Preparation of Plasma Chemical Vapor Deposition Silicon Nitride Films from SiH2F2 and NH3 Source Gases. In: Japanese Journal of Applied Physics. 30, 1991, S. L619, doi:10.1143/JJAP.30.L619.