Methinfarbstoffe
Methinfarbstoffe (Polymethinfarbstoffe) sind Farbstoffe, deren chromophores System aus konjungierten Doppelbindungen besteht (Polyene), die von zwei Endgruppen – einem Elektronenakzeptor A und einem Elektronendonor D – flankiert sind:[1]:S. 68[2]
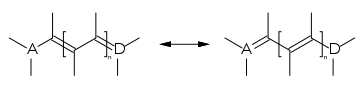
Die Methinfarbstoffe enthalten eine ungerade Anzahl Methingruppen. Die Endgruppen können auch Teil eines Heterocyclus und die Doppelbindungen Teil eines aromatischen Systems sein. Daraus ergeben sich für die Methinfarbstoffe verschiedene Unterklassen. Die Methinfarbstoffe können kationisch, anionisch oder neutral sein.[3]:S. 56–67
Ersetzt man eine oder mehrere Methingruppen durch ein Heteroatom – in aller Regel Stickstoff – so spricht man von heteroanalogen (aza-analogen) Methinfarbstoffen.
Prinzipielle Eigenschaften und Klassifizierung
Methinfarbstoffe lassen sich als Polyenfarbstoffe mit terminalen Elektronendonor- und Akzeptorgruppen charakterisieren. In den überwiegenden Fällen enthalten die Endgruppen der Methinfarbstoffe Stickstoff- oder Sauerstoffatome. Während jedoch die in aller Regel als Naturfarbstoffe vorkommenden Polyenfarbstoffe, wie die Carotinoide, auf gelbe bis gelb-rote Farbtöne beschränkt sind, kann man mit den überwiegend synthetischen Methinfarbstoffen nahezu alle Farben des Spektrums erzielen.
Cyaninfarbstoffe
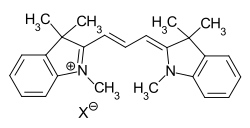
Die bekannteste Gruppe der Methinfarbstoffe sind die kationischen Cyaninfarbstoffe. Beide terminale Gruppen des Chromophors enthalten Stickstoffatome, wobei die Amino-, bzw. Iminogruppe jeweils Teil eines Heterocyclus ist.
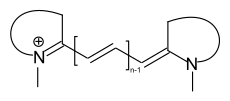
Hemicyaninfarbstoffe
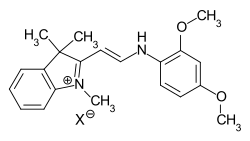
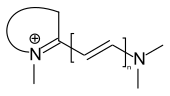
Bei den Hemicyaninfarbstoffe ist eine terminale Aminopgruppe Teil eines Heterocyclus, während die zweite terminale Gruppe offenkettig ist.
Streptocyaninfarbstoffe
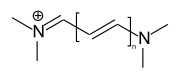
Sind die beiden terminalen Amino- bzw. Iminogruppen des Chromophors offenkettig, so spricht man von Streptocyaninfarbstoffen.
Merocyaninfarbstoffe
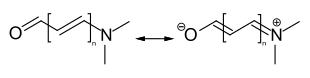
Die Merocyaninfarbstoffen besitzen als Endgruppen des Polyenstrukturelements eine Amino- und eine Carbonylgruppe. Für diesen Verbindungstyp lässt sich sowohl eine neutrale, als auch eine zwitterionische mesomere Grenzstruktur formulieren.[6]
Oxonolfarbstoffe
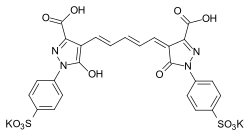
Vertreter der Oxonolfarbstoffe, deren terminale Gruppen Sauerstoff als Heteroatom enthält, spielen eine Rolle in der analogen Farbphotographie.[8]
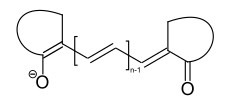
Styrylfarbstoffe
Durch Kondensation einer aktiven Methylenverbindung, beispielsweise Malonsäuredinitril, mit einem Benzaldehyd-Derivat erhält man die zu den Methinfarbstoffen zählenden Styrylfarbstoffe. Durch Integration eines Benzolrings in den Polyenteil besitzen diese Verbindungen eine Styrol-Teilstruktur. Die Styrylfarbstoffe finden Anwendung als Dispersionsfarbstoffe beim Färben von Polyesterfasern.
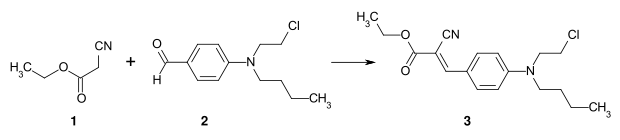
Beispiel: Herstellung von C.I. Disperse Yellow 31 (3) durch Kondensation von Cyanessigsäureethylester (1) mit p-Aminobenzaldehyd-Derivat (2).[3]:S. 58
Di- und Triarylmethinfarbstoffe
Amino- und Hydroxysubstituierte Di- und Triarylmethine besitzen ebenfalls das Strukturelement der Methinfarbstoffe:
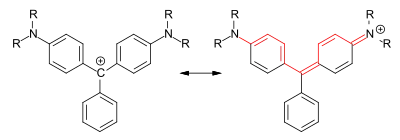
Die Triarylmethinfarbstoffe leiten sich vom Triphenylmethan ab, bei dem mindestens zwei der aromatischen Ringe elektronenliefernde Substituenten aufweisen (z. B. Aminogruppen, sekundäre und tertiäre Alkylaminogruppen oder Hydroxygruppen). Sie werden daher in der älteren Literatur auch als Triarylmethanfarbstoffe bezeichnet. Für die Farbstoffe lassen sich mesomere Grenzstrukturen als Carbeniumion oder mit einer Iminocyclohexadien- bzw. Cyclohexadienon-Teilstruktur formulieren. Das zentrale Kohlenstoffatom in den Farbstoffen ist somit nicht sp3-, sondern sp2-hybridisiert.[1]:S. 58
Triarylmethinfarbstoffe ergeben meist intensive, leuchtende Färbungen mit unterschiedlicher Lichtechtheit. Sie werden außer beim Färben und Bedrucken von Textilien, Leder und Papier auch für Druckfarben, Tinten, in Kugelschreiberpasten und als Mikroskopierfarbstoffe eingesetzt. Als funktionelle Farbstoffe finden einige Vertreter dieser Farbstoffklasse Verwendung als Indikatoren (Phenolphthalein), als Desinfektionsmittel, Anthelminthika und Antimykotika (z. B. Malachitgrün, Kristallviolett).[9]
Beispiele:
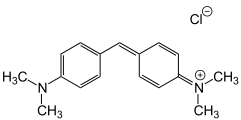 Michlers Hydrol
Michlers Hydrol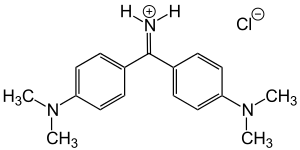
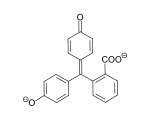 Phenolphthalein (pH 8,2-12)
Phenolphthalein (pH 8,2-12)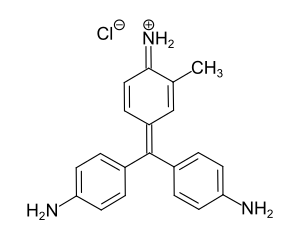
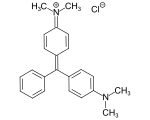 C.I. Basic Green 4 (Malachitgrün)
C.I. Basic Green 4 (Malachitgrün)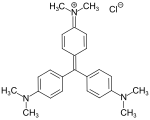 C.I. Basic Violet 3 (Kristallviolett)
C.I. Basic Violet 3 (Kristallviolett)
Als Edukte für die Polymethinfarbstoffe werden üblicherweise die Endgruppen als Nucleophile eingesetzt; in den Beispielen Basic Red 12 und Basic Yellow 11 wären dies die Fischer-Base, in den Beispielen Michlers Hydrol, Solvent Yellow 34, Basic Violet 14, Basic Green 4 und Basic Violet 3 das N,N-Dimethylanilin. Die Methinkette wird üblicherweise als Elektrophil eingebracht, im einfachsten Fall kann dies Formaldehyd sein; bei längeren Ketten bieten sich vinyloge Ameisensäureester an[10].
Aza-analoge Methinfarbstoffe
Ersetzt man eine Methingruppe der Methinfarbstoffe durch ein Stickstoffatom, so erhält man die Azamethinfarbstoffe (Beispiel: C.I. Basic Yellow 28[11]). Entsprechend gelangt man zu den Diazamethinfarbstoffen durch Ersatz von zwei Methingruppen durch Stickstoffatome. Insbesondere die Diazahemicyanin-Farbstoffe (Beispiele: C.I. Basic Red 22[12] und C.I. Basic Blue 41[13]) sind eine wichtige Klasse der Methinfarbstoffe und finden als kationische Farbstoffe Verwendung beim Färben von Polyacrylnitrilfasern.[3]:S. 57, 58
Beispiele:
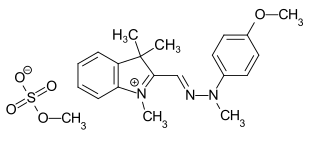 C.I. Basic Yellow 28
C.I. Basic Yellow 28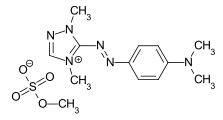 C.I. Basic Red 22
C.I. Basic Red 22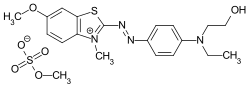 C.I. Basic Blue 41
C.I. Basic Blue 41
Die Chinoniminfarbstoffe sind aza-analoge Vertreter der Diarylmethinfarbstoffe:
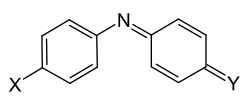
mit X = OH, NH2 oder NR2 Y = O oder NH
Einzelnachweise
- Heinrich Zollinger: Color Chemistry: Syntheses, Properties, and Applications of Organic Dyes and Pigments. 3. Auflage. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-906390-23-3 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Polymethin-Farbstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Februar 2019.
- Klaus Hunger (Hrsg.): Industrial Dyes: Chemistry, Properties, Applications. WILEY-VCH Verlag, Weinheim 2003, ISBN 978-3-662-01950-4 (eingeschränkte Vorschau in der Google-Buchsuche).
- Externe Identifikatoren von bzw. Datenbank-Links zu Basic Red 12: CAS-Nummer: 6320-14-5, EG-Nummer: 228-668-0, ECHA-InfoCard: 100.026.062, PubChem: 6540442, ChemSpider: 4645019, Wikidata: Q72444849.
- Externe Identifikatoren von bzw. Datenbank-Links zu Basic Yellow 11: CAS-Nummer: 4208-80-4, EG-Nummer: 224-132-5, ECHA-InfoCard: 100.021.939, PubChem: 6436295, ChemSpider: 66308, Wikidata: Q27251133.
- Eintrag zu Merocyanine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Juli 2019.
- Externe Identifikatoren von bzw. Datenbank-Links zu Oxonol Blau, Dikaliumsalz: CAS-Nummer: 51858-17-4, EG-Nummer: 257-479-6, ECHA-InfoCard: 100.052.237, PubChem: 20833147, ChemSpider: 29272125, Wikidata: Q82869407.
- Eintrag zu Oxonol-Farbstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Juli 2019.
- Eintrag zu Triarylmethan-Farbstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Februar 2019.
- Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Thieme, Stuttgart 2005, S. 719 (eingeschränkte Vorschau in der Google-Buchsuche).
- Externe Identifikatoren von bzw. Datenbank-Links zu Basic Yellow 28: CAS-Nummer: 54060-92-3, EG-Nummer: 258-946-7, ECHA-InfoCard: 100.053.570, PubChem: 9570625, ChemSpider: 7845092, Wikidata: Q27254755.
- Externe Identifikatoren von bzw. Datenbank-Links zu Basic Red 22: CAS-Nummer: 12221-52-2, EG-Nummer: 602-140-3, ECHA-InfoCard: 100.115.765, PubChem: 73759884, ChemSpider: 21167832, Wikidata: Q27268936.
- Externe Identifikatoren von bzw. Datenbank-Links zu Basic Blue 41: CAS-Nummer: 12270-13-2, EG-Nummer: 235-546-0, ECHA-InfoCard: 100.032.302, PubChem: 83008, ChemSpider: 74891, Wikidata: Q27252322.