Inovirus
Inovirus ist die offizielle Bezeichnung für eine Klade filamentöser Bakteriophagen (Bakterien infizierender Viren) der Familie Inoviridae, die das F-Plasmid (Fertilitätsfaktor) tragen; daher ist für sie auch die informelle Bezeichnung Ff-Phagen (englisch Ff phages für F-specific filamentous phages) gebräuchlich. Zu ihnen gehören die Phagen f1, fd, und M13; möglicherweise auch ZJ/2 (ein bisher nicht-klassifiziertes/vorgeschlagenes Mitglied der Inoviridae[2]).[3][4][5][6][7][8][9]
| Inovirus | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

Virionen des Filamentösen Bakteriophagen fd | ||||||||||||||||
| Systematik | ||||||||||||||||
| ||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||
| ||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||
| Inovirus | ||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||
| Ff | ||||||||||||||||
| Links | ||||||||||||||||
|
Die Virionen (Virusteilchen) der Gattung Inovirus sind flexible Filamente mit einer Länge von etwa 600 bis 900 nm. Sie umfassen eine zylindrische Proteinröhre, die in ihrem Kern ein einzelsträngiges zirkuläres DNA-Molekül schützt. Das Genom kodiert für nur 11 Genprodukte, damit sind diese Phagen unter einfachsten bekannten Organismen überhaupt. Inovirus-Phagen wurden häufig zur Untersuchung grundlegender Aspekte der Molekularbiologie verwendet. George Smith und Greg Winter verwendeten f1 und fd für ihre Arbeiten zum Phagen-Display, für die sie einen Teil des Nobelpreises für Chemie 2018 erhielten.[10]
Systematik
Die Systematik der Gattung Inovirus ist nach International Committee on Taxonomy of Viruses (ICTV)[1] und NCBI mit Stand Anfang April 2021 etwa wie folgt:
Familie: Inoviridae
- Gattung: Inovirus (informell: Ff-Phagen, Ff phages, Akronym Ff)
- Spezies: Escherichia-Virus M13 (en. Escherichia virus M13, Typus)
- Stamm: Bakteriophage M13 (alias Coliphage M13, Akronym M13, Referenzstamm)
- Stamm: Enterobacteria phage f1 (alias Coliphage f1, Akronym f1)
- Spezies: „Enterobacteria phage fd“ (per Vorschlag zur selben Gattung)
- Stamm: Bakteriophage fd (alias Coliphage fd, Akronym fd)
- Mutante: fd-pIIICTX – infiziert Vibrio cholerae, da in Gen g3 Sequenzen durch Fragmente des Gens orfU von Vibrio-Phage CTXφ ersetzt wurden, siehe §Anwendungen[11]
Die Familie Inoviridae Mitglied der Ordnung Tubulavirales, in der noch weitere filamentöse Viren taxonomisch untergebracht sind.
Aufbau
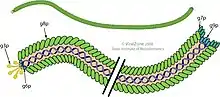
_assembled_major_coat_protein%252C_exploded_view.tif.jpg.webp)
Ein Inovirus- Partikel (Virion) ist ein flexibles Filament (wurmartige Kette) mit einem Durchmesser von etwa 6 nm und einer Länge von 900 nm. Mehrere tausend Kopien einer elongierten (langgestreckten) kleinen Untereinheit von 50 Aminosäure-Bausteinen bilden das Hauptkapsidprotein (major capsid protein, MCP), das speziell bei diesen filamentösen Viren (als Produkt von Gen 8) mit (p8 oder g8p) bezeichnet wird und aus 50 Aminosäure-Bausteinen besteht. Diese Untereinheiten bilden in einer überlappenden schindelartigen Anordnung einen Hohlzylinder, der das unsegmentierte (topologisch) zirkuläre Einzelstrang-DNA-Genom umschließt. Jede p8-Untereinheit hat eine Ansammlung von basischen Resten in der Nähe des C-Terminus des langgestreckten Proteins und saure Reste in der Nähe des N-Terminus; diese beiden Regionen sind durch etwa 20 hydrophobe (unpolare) Reste getrennt. Die schindelartige Anordnung platziert
- die sauren Reste von p8 in der Nähe der äußeren Oberfläche des Zylinders (weshalb das Viruspartikel dort elektrisch negativ geladen ist);
- die nicht-polare Regionen in der Nähe der nicht-polaren Regionen der benachbarten p8-Untereinheiten, so dass nicht-polare Wechselwirkungen zu einer bemerkenswerten physikalischen Stabilität des Viruspartikels beitragen;
- und die basische Reste in der Nähe des Zentrums des Zylinders, wo sie mit den negativ geladenen DNA-Phosphaten im Kern des Virions wechselwirken.
Längere[12] (oder kürzere[13]) DNA-Moleküle können verpackt werden, da während des Zusammenbaus je nach Bedarf mehr (oder weniger) p8-Untereinheiten hinzugefügt werden können, um die DNA zu schützen. Dies ist ein Umstand, der den Phagen für genetische Studien sehr nützlich macht. (Dieser Effekt sollte nicht mit dem Polyphagen verwechselt werden, der mehrere separate und unterschiedliche DNA-Moleküle verpacken kann). Jeweils etwa 5 Kopien von vier kleineren Proteinen bedecken die beiden Enden des Virions.[14]
Die molekulare Struktur des Virionenkapsids (die Anordnung der p8-Untereinheiten-Proteine) wurde durch Röntgenfaserbeugung bestimmt, und Strukturmodelle wurden in der Protein Data Bank (PDB) hinterlegt.[15] Die Strukturen des p3-Kapsidproteins und des p5-Replikations/Assemblierungsproteins wurden ebenfalls durch Röntgenkristallographie bestimmt und in der PDB hinterlegt.
Genom
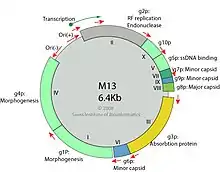
Das fd-Genom hat eine Länge von 6408 nt (Nukleotiden), die 9 Gene umfassen, aber das Genom hat 11 offene Leserahmen (en. open reading frames, ORFs), die 11 Proteine produzieren. Grund ist, dass zwei Gene, Gen 2 und Gen 1, interne In-Frame-Translationsstarts haben, die zwei zusätzliche Proteine, p10 und p11, erzeugen. Das Genom enthält auch eine kurze nicht-kodierende intergenische Sequenz (Zwischengensequenz, en. intergenic sequence).[16]
Die Sequenzen von M13 und f1 unterscheiden sich geringfügig von fd. Sie haben beide eine Länge von nur 6407 nt; f1 unterscheidet sich von fd in 180 Positionen; nur 10 dieser Änderungen spiegeln sich auch in Aminosäureänderungen in den Genprodukten (Proteinen) wider[17] und M13 hat nur 59 Nukleotidunterschiede zu f1. In frühen Experimenten mit Ff-Phagen wurde M13 verwendet, um Genfunktionen zu identifizieren,[18][19] und M13 wurde auch als Klonierungsvehikel entwickelt,[20] daher wird der Name "M13-Phagen" oft informell als Abkürzung für "Ff-Phagen" verwendet (Typusspezies/Referenzstamm). Für viele Zwecke können die Phagen der Ff-Gruppe als austauschbar betrachtet werden.
Fünf Genprodukte sind Teil des Virions:[Anm. 1][21]
- das Haupt-Kapsidprotein (en. major capsid protein, MCP), hier: p8;
- die kleineren Proteine (en. minor capsid proteins, mCPs), die die beiden Enden abdecken: p3 und p6 an einem Ende und p7 und p9 am anderen Ende;
- drei Genprodukte (p2, p5 und p10) sind Proteine, die für die DNA-Synthese im Zytoplasma der Wirtszelle benötigt werden;
- der Rest sind Membranproteine, die an der Montage des Virions (Assemblierung) beteiligt sind;
- das Gen, das für p1 kodiert, wurde als konserviertes Markergen zusammen mit drei anderen Merkmalen, die spezifisch für Inovirus-Genome sind, in einem automatischen Machine-Learning-Ansatz (en. automatic machine-learning approach) verwendet, um über 10000 Inovirus-ähnliche Sequenzen aus mikrobiellen Genomen zu identifizieren.[22]
Repilkationszyklus
Infektion
Das p3-Protein ist an einem Ende des Virions durch die C-terminale Domäne von p3 verankert. Bei der Infektion von Wirtsbakterien interagieren zwei verschiedene N-terminale Regionen von p3 mit zwei verschiedenen Stellen der Wirtsbakterien. Zunächst heftet sich die N2-Domäne von p3 an die äußere Spitze des F-Pilus, und der Pilus zieht sich in die Zelle zurück. Diese Retraktion kann eine Depolymerisation der Pilusuntereinheit in die Zellmembran an der Basis des Pilus durch eine Umkehrung des Piluswachstums- und Polymerisationsprozesses beinhalten.[3][23][24] Wenn sich die Spitze des Pilus, der p3 trägt, der Zellwand nähert, interagiert die N1-Domäne von p3 mit dem bakteriellen Protein TolQRA (vgl. en:CTXφ bacteriophage – das zugehörige Gen ist tolQRA). TolQRA hilft, den Ff-Phagen in den In E. coli wirkt TolQRA, um den Ff-Phagen in den periplasmatischen Raum zu verbringen (translozieren), wo eine mögliche Membranfusion zur Freisetzung (Insertion) des Ff-Genoms in das Zytoplasma des Wirtsbakteriums führt.[25][26][27]
Die Verhältnisse sind ähnlich wie beim Träger des Gens für das Choleratoxin, dem Vibrio-Phagen CTXphi (Spezies Vibrio-Virus CTXphi der Gattung Affertcholeramvirus) in derselben Virusfamilie. Dieser benötigt Vibrionenstämme, die den sog. TCP-Faktor (Toxin-regulierter Pilus, en. toxin-coregulated pilus) kodieren (tcpA-Gen). Dieser Pilus dient dort zusammen mit TolQRA als Virusrezeptor.[28][29][30]
Replikation
Nachdem die einzelsträngige virale DNA ins Zytoplasma gelangt ist, dient sie als Vorlage für die Synthese eines komplementären DNA-Strangs. Diese Synthese wird in der intergenischen Region der DNA-Sequenz durch die RNA-Polymerase des Wirts initiiert, die einen kurzen RNA-Primer an der infizierenden DNA als Template synthetisiert. Die DNA-Polymerase III des Wirts verwendet dann diesen Primer, um den vollständigen komplementären DNA-Strang zu synthetisieren, wodurch ein doppelsträngiger Kreis entsteht, der manchmal als replikative Form (RF) der DNA bezeichnet wird. Der komplementäre Strang der RF ist die Transkriptionsvorlage für virale (phagenkodierte) Proteine, insbesondere p2 und p10, die für die weitere DNA-Replikation notwendig sind.[8]
Das Protein p2 spaltet den Strang der RF-DNA des Virus, und die DNA-Polymerase III des Wirts synthetisiert einen neuen viralen Strang. Während der neue Virusstrang synthetisiert wird, wird der alte verdrängt. Wenn der Kreis geschlossen ist, schneidet das kovalent verknüpfte p2 den verdrängten viralen Strang an der Verbindungsstelle zwischen der alten und der neu synthetisierten DNA und re-ligiert (verbindet) die beiden Enden und setzt p2 frei. RF repliziert durch diesen Rolling-Circle-Mechanismus, um Dutzende von Kopien des RF zu erzeugen.[8]
Wenn später die Konzentration der Phagenproteinen erhöht ist, werden neue virale Stränge durch das Replikations/Assemblierungsprotein p5 und nicht durch die komplementären DNA-Stränge umhüllt. Das p5 hemmt auch die Translation von p2, so dass die Produktion der viralen ssDNA und die Verpackung der Nachkommen synchron verlaufen.[8]
Assemblierung und Extrusion
Die Infektion tötet die Wirtsbakterien nicht ab,[31] im Gegensatz zu vielen anderen Phagenfamilien mit lytischem Replikationszyklus. Die Nachkommen der Phagen werden zusammengebaut, während sie durch die Membran des weiter wachsenden Wirtsbakteriums extrudieren. Dies geschieht wahrscheinlich an Adhäsionsstellen, die die innere und äußere Membran verbinden. Der Extrusionsprozess nimmt die Proteine p7 und p9 auf, die die äußere Spitze des neugebildeten Phagen bilden. Während p5 von der DNA abgestreift wird, wird die neue Phagen-DNA durch die Membran extrudiert und in eine helikale Kapsidhülle aus p8 eingewickelt, zu der am Ende der Assemblierung p3 und p6 hinzugefügt werden. Das Protein p4 kann für diesen Vorgang eine Extrusionspore in der äußeren Membran des Bakteriums bilden.[14][32][33][34][35][36]
Anwendungen
Life Sciences und Medizin
Ff-Phagen sind für viele Anwendungen in den biologischen und medizinischen Wissenschaften benutzt worden. Viele Anwendungen bauen auf Experimenten auf, die zeigten, dass die DNA-Sequenz, die die Resistenz gegen das Antibiotikum Kanamycin bestimmt, in einer funktionellen Form in die nicht-kodierende intergenische Sequenz der fd-Phagen-DNA eingefügt werden kann.[12] Solche modifizierten Phagen sind entsprechend länger als die fd-Phagen des Wildtyps, wobei die längere DNA mit entsprechend mehr Gen-8-Hüllproteinen umhüllt ist, aber der Lebenszyklus der Phagen ist ansonsten nicht gestört. Bei den herkömmlichen Bakteriophagen mit Kopf-Schwanz-Aufbau (im der Klasse Caudoviricetes) oder gar mit isometrischem Kapsid ist das Kapsid von begrenzter Größe, daher können sie nicht einfach für die Verkapselung eines größeren DNA-Moleküls verwendet werden.[Anm. 2] Die modifizierten filamentösen Phagen können selektiert werden, indem man ursprünglich kanamycinempfindliche Bakterien mit modifizierten Phagen infiziert, die (unter anderem) eine Resistenz gegen Kanamycin vermitteln. Werden die Bakterien in Medien gezüchtet, die eine für die ursprünglichen Bakterien tödliche Konzentration von Kanamycin enthalten, so überleben nur infizierte Bakterien, und mit ihnen die modifizierten Phagen. Diese Methoden wurden noch im Lauf der Jahre auf vielfältige Weise erweitert und verfeinert und die Phagen-Display-Technologie wird heute für eine Vielzahl von Zwecken eingesetzt.[37][38][39][40][41][42]
Ein Beispiel ist eine künstliche Mutante des fd-Phagen mit Bezeichnung fd-pIIICTX. Dort wurden im Gen g3 (des Proteins p3 alias g3p) Sequenzen durch Fragmente des Gens orfU von Vibrio-Phage CTXφ ersetzt. Dadurch ist der Phage in der Lage, Bakterien der Gattung Vibrio cholerae (zu der die Cholera-Erreger gehören) zu infizieren.[11]
Materialwissenschaft and Nanotechnologie
Ff-Phagen wurden ebenso für Anwendungen wie Sanierungen, elektrochemische, photovoltaische, katalytische, sensorische und digitale Speichergeräte entwickelt, insbesondere von Angela Belcher und Kollegen.[8][43][44][45][46][47][48][49][50]
Phagemid
Anmerkungen
- Für die Proteine sind verschiedene Bezeichnungen im Gebrauch, die aber einender entsprechen: g1p = p1, g2p = p2, g2p = p2, etc. Die entsprechenden Gene werden einheitlich mit g1, g2, etc. bezeichnet.
- Viren mit segmentiertem Genom, die dessen Segmente einzeln in Kapside verpacken, sind eine rare (oder wenig erforschte) Ausnahme.
Einzelnachweise
- ICTV: ICTV Master Species List 2019.v1, New MSL including all taxa updates since the 2018b release, March 2020 (MSL #35)
- NCBI: Enterobacteria phage ZJ/2 (species)
- Rasched I, Oberer E: Ff coliphages: structural and functional relationships. In: Microbiological Reviews. 50, Nr. 4, Dezember 1986, S. 401–427. doi:10.1128/MR.50.4.401-427.1986. PMID 3540571. PMC 373080 (freier Volltext).
- Mai-Prochnow A, Hui JG, Kjelleberg S, Rakonjac J, McDougald D, Rice SA: Big things in small packages: the genetics of filamentous phage and effects on fitness of their host. In: FEMS Microbiology Reviews. 39, Nr. 4, Juli 2015, S. 465–487. doi:10.1093/femsre/fuu007. PMID 25670735.
- Rakonjac J, Bas B, Derda R (Hrsg.): Filamentous Bacteriophage in Bio/Nano/Technology, Bacterial Pathogenesis and Ecology (= Frontiers Research Topics). Frontiers Media SA, 2017, ISBN 978-2-88945-095-4, doi:10.3389/978-2-88945-095-4.
- Morag O, Abramov G, Goldbourt A: Similarities and differences within members of the Ff family of filamentous bacteriophage viruses. In: The Journal of Physical Chemistry B. 115, Nr. 51, Dezember 2011, S. 15370–15379. doi:10.1021/jp2079742. PMID 22085310.
- I. D. Hay, T. Lithgow: Filamentous phages: masters of a microbial sharing economy. In: EMBO Reports. 20, Nr. 6, Juni 2019. doi:10.15252/embr.201847427. PMID 30952693. PMC 6549030 (freier Volltext).
- Rakonjac J, Bennett NJ, Spagnuolo J, Gagic D, Russel M: Filamentous bacteriophage: biology, phage display and nanotechnology applications. In: Current Issues in Molecular Biology. 13, Nr. 2, 2011, S. 51–76. PMID 21502666.
- J. Rakonjac, M. Russel, S. Khanum, S. J. Brooke, M. Rajič; T. S. Lim (Hrsg.): Filamentous Phage: Structure and Biology. In: Springer International Publishing, Cham (Hrsg.): Advances in Experimental Medicine and Biology. 1053, 2017, S. 1–20. doi:10.1007/978-3-319-72077-7_1. PMID 29549632. ISBN 978-3-319-72076-0
- The Nobel Prize in Chemistry 2018 (en-US) In: NobelPrize.org. Abgerufen am 10. April 2021.
- Andrew J. Heilpern, Matthew K. Waldor: pIIICTX, a predicted CTXphi minor coat protein, can expand the host range of coliphage fd to include Vibrio cholerae, in: J Bacteriol 185(3), Februar 2003, S. 1037–1044, doi:10.1128/jb.185.3.1037-1044.2003, PMID 12533480, PMC 142820 (freier Volltext)
- Herrmann R, Neugebauer K, Zentgraf H, Schaller H: Transposition of a DNA sequence determining kanamycin resistance into the single-stranded genome of bacteriophage fd. In: Molecular & General Genetics. 159, Nr. 2, Februar 1978, S. 171–178. doi:10.1007/BF00270890. PMID 345091.
- Sattar S, Bennett NJ, Wen WX, Guthrie JM, Blackwell LF, Conway JF, Rakonjac J: Ff-nano, short functionalized nanorods derived from Ff (f1, fd, or M13) filamentous bacteriophage. In: Frontiers in Microbiology. 6, 2015, S. 316. doi:10.3389/fmicb.2015.00316. PMID 25941520. PMC 4403547 (freier Volltext).
- Straus SK, Bo HE: Filamentous Bacteriophage Proteins and Assembly. In: Sub-Cellular Biochemistry. 88, 2018, S. 261–279. doi:10.1007/978-981-10-8456-0_12. PMID 29900501. ISBN 978-981-10-8455-3
- Inoviridae ~ ViralZone. In: viralzone.expasy.org. Abgerufen am 16. April 2021.
- Beck E, Sommer R, Auerswald EA, Kurz C, Zink B, Osterburg G, Schaller H, Sugimoto K, Sugisaki H, Okamoto T, Takanami M: Nucleotide sequence of bacteriophage fd DNA. In: Nucleic Acids Research. 5, Nr. 12, Dezember 1978, S. 4495–4503. doi:10.1093/nar/5.12.4495. PMID 745987. PMC 342768 (freier Volltext).
- E. Beck, B. Zink: Nucleotide sequence and genome organisation of filamentous bacteriophages fl and fd. In: Gene. 16, Nr. 1–3, Dezember 1981, S. 35–58. doi:10.1016/0378-1119(81)90059-7. PMID 6282703.
- Pratt D, Tzagoloff H, Erdahl WS: Conditional lethal mutants of the small filamentous coliphage M13. I. Isolation, complementation, cell killing, time of cistron action. In: Virology. 30, Nr. 3, November 1966, S. 397–410. doi:10.1016/0042-6822(66)90118-8. PMID 5921643.
- Pratt D, Tzagoloff H, Beaudoin J: Conditional lethal mutants of the small filamentous coliphage M13. II. Two genes for coat proteins. In: Virology. 39, Nr. 1, September 1969, S. 42–53. doi:10.1016/0042-6822(69)90346-8. PMID 5807970.
- J. Messing: Cloning in M13 phage or how to use biology at its best. In: Gene. 100, April 1991, S. 3–12. doi:10.1016/0378-1119(91)90344-b. PMID 2055478.
- M. Russel, N. A. Linderoth, A. Sali: Filamentous phage assembly: variation on a protein export theme. In: Gene. 192, Nr. 1, Juni 1997, S. 23–32. doi:10.1016/s0378-1119(96)00801-3. PMID 9224870.
- Roux S, Krupovic M, Daly RA, Borges AL, Nayfach S, Schulz F, Sharrar A, Matheus Carnevali PB, Cheng JF, Ivanova NN, Bondy-Denomy J, Wrighton KC, Woyke T, Visel A, Kyrpides NC, Eloe-Fadrosh EA: Cryptic inoviruses revealed as pervasive in bacteria and archaea across Earth's biomes. In: Nature Microbiology. 4, Nr. 11, November 2019, S. 1895–1906. doi:10.1038/s41564-019-0510-x. PMID 31332386. PMC 6813254 (freier Volltext).
- Lawley TD, Klimke WA, Gubbins MJ, Frost LS: F factor conjugation is a true type IV secretion system. In: FEMS Microbiology Letters. 224, Nr. 1, Juli 2003, S. 1–15. doi:10.1016/S0378-1097(03)00430-0. PMID 12855161.
- Craig L, Forest KT, Maier B: Type IV pili: dynamics, biophysics and functional consequences. In: Nature Reviews. Microbiology. 17, Nr. 7, Juli 2019, S. 429–440. doi:10.1038/s41579-019-0195-4. PMID 30988511.
- Bennett NJ, Rakonjac J: Unlocking of the filamentous bacteriophage virion during infection is mediated by the C domain of pIII. In: Journal of Molecular Biology. 356, Nr. 2, Februar 2006, S. 266–273. doi:10.1016/j.jmb.2005.11.069. PMID 16373072.
- Hoffmann-Thoms S, Jakob RP, Schmid FX: Energetic communication between functional sites of the gene-3-protein during infection by phage fd. In: Journal of Molecular Biology. 426, Nr. 8, April 2014, S. 1711–1722. doi:10.1016/j.jmb.2014.01.002. PMID 24440124.
- Eva Marie Click, Robert E. Webster: The TolQRA Proteins Are Required for Membrane Insertion of the Major Capsid Protein of the Filamentous Phage f1 during Infection, in: J Bacteriol. 180(7), April 1998; S. 1723–1728, doi:10.1128/JB.180.7.1723-1728.1998, PMC 107083 (freier Volltext), PMID 9537368
- Andrew J. Heilpern, Matthew K. Waldor: CTXφ Infection of Vibrio cholerae Requires the tolQRA Gene Products. In: Journal of Bacteriology. 182, Nr. 6, 2000, S. 1739–1747. doi:10.1128/JB.182.6.1739-1747.2000. PMID 10692381. PMC 94473 (freier Volltext).
- M. Li, M. Kotetishvili, Y. Chen, S. Sozhamannan: Comparative genomic analyses of the vibrio pathogenicity island and cholera toxin prophage regions in nonepidemic serogroup strains of Vibrio cholerae. In: Applied and environmental microbiology. Band 69, Nummer 3, März 2003, S. 1728–1738, PMID 12620865. PMC 150053 (freier Volltext).
- David K. R. Karaolis, Sita Somara, David R. Maneval, Judith A. Johnson, James B. Kaper: A bacteriophage encoding a pathogenicity island, a type-IV pilus and a phage receptor in cholera bacteria. In: Nature. Band 399, Nummer 6734, Mai 1999, S. 375–379, doi:10.1038/20715. PMID 10360577.
- Hoffmann Berling H, Maze R: Release of male-specific bacteriophages from surviving host bacteria BACTERIA. In: Virology. 22, Nr. 3, März 1964, S. 305–313. doi:10.1016/0042-6822(64)90021-2. PMID 14127828.
- M. P. Rapoza, R. E. Webster: The products of gene I and the overlapping in-frame gene XI are required for filamentous phage assembly. In: Journal of Molecular Biology. 248, Nr. 3, Mai 1995, S. 627–638. doi:10.1006/jmbi.1995.0247. PMID 7752229.
- Griffith J, Manning M, Dunn K: Filamentous bacteriophage contract into hollow spherical particles upon exposure to a chloroform-water interface. In: Cell. 23, Nr. 3, März 1981, S. 747–753. doi:10.1016/0092-8674(81)90438-4. PMID 7226228.
- Manning M, Griffith J: Association of M13 I-forms and spheroids with lipid vesicles. In: Archives of Biochemistry and Biophysics. 236, Nr. 1, Januar 1985, S. 297–303. doi:10.1016/0003-9861(85)90629-0. PMID 3966795.
- Stopar D, Spruijt RB, Wolfs CJ, Hemminga MA: Mimicking initial interactions of bacteriophage M13 coat protein disassembly in model membrane systems. In: Biochemistry. 37, Nr. 28, Juli 1998, S. 10181–10187. doi:10.1021/bi9718144. PMID 9665724.
- Roberts LM, Dunker AK: Structural changes accompanying chloroform-induced contraction of the filamentous phage fd. In: Biochemistry. 32, Nr. 39, Oktober 1993, S. 10479–10488. doi:10.1021/bi00090a026. PMID 8399194.
- G. Smith: Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. In: Science. 228, Nr. 4705, 1985, ISSN 0036-8075, S. 1315–1317. doi:10.1126/science.4001944.
- Stephen F. Parmley, George P. Smith: Antibody-selectable filamentous fd phage vectors: affinity purification of target genes. In: Gene. 73, Nr. 2, 1988, ISSN 0378-1119, S. 305–318. doi:10.1016/0378-1119(88)90495-7.
- Greg Winter, Andrew D. Griffiths, Robert E. Hawkins, Hennie R. Hoogenboom: Making Antibodies by Phage Display Technology. In: Annual Review of Immunology. 12, Nr. 1, 1994, ISSN 0732-0582, S. 433–455. doi:10.1146/annurev.iy.12.040194.002245.
- Prisco A, De Berardinis P: Filamentous bacteriophage fd as an antigen delivery system in vaccination. In: International Journal of Molecular Sciences. 13, Nr. 4, 2012, S. 5179–5194. doi:10.3390/ijms13045179. PMID 22606037. PMC 3344273 (freier Volltext).
- Henry KA, Arbabi-Ghahroudi M, Scott JK: Beyond phage display: non-traditional applications of the filamentous bacteriophage as a vaccine carrier, therapeutic biologic, and bioconjugation scaffold. In: Frontiers in Microbiology. 6, 2015, S. 755. doi:10.3389/fmicb.2015.00755. PMID 26300850. PMC 4523942 (freier Volltext).
- Sioud M: Phage Display Libraries: From Binders to Targeted Drug Delivery and Human Therapeutics. In: Molecular Biotechnology. 61, Nr. 4, April 2019, S. 286–303. doi:10.1007/s12033-019-00156-8. PMID 30729435.
- Dogic Z: Filamentous Phages As a Model System in Soft Matter Physics. In: Frontiers in Microbiology. 7, 2016, S. 1013. doi:10.3389/fmicb.2016.01013. PMID 27446051. PMC 4927585 (freier Volltext).
- Oh D, Qi J, Lu YC, Zhang Y, Shao-Horn Y, Belcher AM: Biologically enhanced cathode design for improved capacity and cycle life for lithium-oxygen batteries. In: Nature Communications. 4, Nr. 1, 2013, S. 2756. bibcode:2013NatCo...4.2756O. doi:10.1038/ncomms3756. PMID 24220635. PMC 3930201 (freier Volltext).
- Dorval Courchesne NM, Klug MT, Huang KJ, Weidman MC, Cantú VJ, Chen PY, Kooi SE, Yun DS, Tisdale WA, Fang NX, Belcher AM: Constructing Multifunctional Virus-Templated Nanoporous Composites for Thin Film Solar Cells: Contributions of Morphology and Optics to Photocurrent Generation. In: The Journal of Physical Chemistry C. 2015, ISSN 1932-7447, S. 150610114441003. doi:10.1021/acs.jpcc.5b00295.
- Lee SW, Belcher AM: Virus-Based Fabrication of Micro- and Nanofibers Using Electrospinning. In: Nano Letters. 4, Nr. 3, 2004, ISSN 1530-6984, S. 387–390. bibcode:2004NanoL...4..387L. doi:10.1021/nl034911t.
- Casey JP, Barbero RJ, Heldman N, Belcher AM: Versatile de novo enzyme activity in capsid proteins from an engineered M13 bacteriophage library. In: Journal of the American Chemical Society. 136, Nr. 47, November 2014, S. 16508–16514. doi:10.1021/ja506346f. PMID 25343220.
- Zhang G, Wei S, Belcher AM: Biotemplated Zinc Sulfide Nanofibers as Anode Materials for Sodium-Ion Batteries. In: ACS Applied Nano Materials. 1, Nr. 10, 2018, ISSN 2574-0970, S. 5631–5639. doi:10.1021/acsanm.8b01254.
- Li L, Belcher AM, Loke DK: Simulating selective binding of a biological template to a nanoscale architecture: a core concept of a clamp-based binding-pocket-favored N-terminal-domain assembly. In: Nanoscale. 12, Nr. 47, Dezember 2020, S. 24214–24227. doi:10.1039/D0NR07320B. PMID 33289758.
- Brogan AP, Heldman N, Hallett JP, Belcher AM: Thermally robust solvent-free biofluids of M13 bacteriophage engineered for high compatibility with anhydrous ionic liquids. In: Chemical Communications. 55, Nr. 72, September 2019, S. 10752–10755. doi:10.1039/C9CC04909F. PMID 31432818.
Weblinks
- ViralZone
- ATCC fd
- ATCC M13
- Andrew J. Heilpern, Matthew K. Waldor: pIIICTX, a predicted CTXphi minor coat protein, can expand the host range of coliphage fd to include Vibrio cholerae, in: J Bacteriol 185(3), Februar 2003, S. 1037–1044, doi:10.1128/jb.185.3.1037-1044.2003, PMID 12533480, PMC 142820 (freier Volltext)