Hexogen
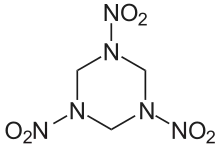
Hexogen, auch Cyclotrimethylentrinitramin, Cyclonit, T4 und RDX (Research Department Explosive / Royal Demolition Explosive) genannt, ist ein hochbrisanter, giftiger Sprengstoff aus der Gruppe der Nitramine, der während des Zweiten Weltkriegs in großen Mengen hergestellt wurde und immer noch eingesetzt wird. Der systematische Name von Hexogen lautet 1,3,5-Trinitro-1,3,5-triazinan.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexogen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H6N6O6 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 222,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,82 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
schlecht in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 1,5 mg·m−3 (gemessen als einatembarer Staub)[3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Hexogen wurde 1898 von dem Berliner Chemiker und pharmazeutischen Unternehmer Georg Friedrich Henning als Explosivstoff zur technischen Verwertung und als Ausgangsmaterial für pharmazeutische Präparate erstmals hergestellt und im deutschen Reichspatent unter der Nr. 104280 vom 15. Juli 1898 beschrieben. Im Jahre 1920 erforschte man im Militärversuchsamt in Berlin die Substanz näher und nannte sie nun Hexogen.
Die Herstellungsverfahren waren anfangs unwirtschaftlich. Erst in den 1930er Jahren wurden vier neue Verfahren in Deutschland entwickelt und Hexogen unter verschiedenen Decknamen wie K-, SH-, E- oder W-Salz im Zweiten Weltkrieg angewendet. Analoge Verfahren wurden auch auf alliierter Seite entwickelt, z. B. das Bachmann-Verfahren in den USA. Hexogen war auch Bestandteil eines der ersten Plastiksprengstoffe, der von Deutschland unter diesem Namen im Zweiten Weltkrieg angewendet wurde und aus 88 % Hexogen und 12 % Vaseline bestand.
Heutzutage werden unterschiedliche Kombinationen verwendet, so z. B. Torpex, bestehend aus 40 % Hexogen, 42 % TNT und 18 % Aluminium.
Hexogen ist chemisch und thermisch sehr stabil und ist auch heute noch einer der brisantesten Sprengstoffe mit hoher Arbeitsleistung. Die Substanz ist der wichtigste, praktisch angewendete militärische Explosivstoff.
Gewinnung und Darstellung
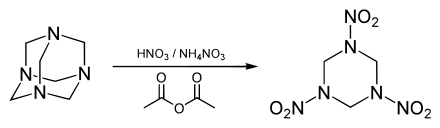
Beim S-H-Verfahren gewinnt man Hexogen durch Nitrolyse aus Hexamethylentetramin (Urotropin, Hexamin) und hochkonzentrierter Salpetersäure (98–99 %). Aufgrund der hohen Explosionsgefahr ist die Herstellung an die Einhaltung genauer Synthesevorschriften gebunden. Technische Verfahren arbeiten modifiziert unter Verwendung von Zusatzstoffen, die Wasser binden (Essigsäureanhydrid im KA- oder Bachmann-Verfahren) und zusätzlich Ammoniumionen liefern (Ammoniumnitrat im K-Verfahren). Hexamethylentetramin (Urotropin) ist ein Kondensationsprodukt aus Ammoniak und Formaldehyd, welches sich beim gemeinsamen Eindampfen der wässrigen, leicht alkalischen Lösungen bildet. Als Nebenprodukt dieser Synthese bilden sich stets einige Prozente Octogen, welches durch Zusätze von Bortrifluorid bevorzugt gebildet werden kann. Beim E-Verfahren erfolgt die Umsetzung von Paraformaldehyd und Ammoniumnitrat in Essigsäureanhydrid.[4]
Die Herstellung und Handhabung von Hexogen hat in der Vergangenheit bereits zu Umwelt- und Trinkwasservergiftungen geführt.
Eigenschaften
Das Hexogen-Molekül hat eine ringförmige Struktur mit drei Stickstoffatomen (Triazinanring), es ist ein gesättigter Heterocyclus.
Die im Hexogen vorhandenen Nitrogruppen (-NO2) treten in vielen Sprengstoffen auf, zum Beispiel auch im TNT oder – als Salpetersäureestergruppe (-O-NO2) – in der Schießbaumwolle. Da die Nitrogruppe an einen Aminstickstoff (dieser enthält ein freies Elektronenpaar) gebunden ist, wird die Struktur stabilisiert (capto-datives Strukturelement). Bei Nitraten ist die Nitrogruppe dagegen an ein Sauerstoffatom gebunden, welcher zwar zwei freie Elektronenpaare besitzt, aber deutlich elektronegativer als der Stickstoff ist. Entsprechend ist die Temperaturstabilität von Nitraminen wesentlich größer als jene vergleichbarer Nitrate.
Physikalische Eigenschaften
Hexogen ist ein farbloser kristalliner Feststoff, der bei 204 °C mit einer Schmelzwärme von 37,66 kJ·mol−1 schmilzt.[5] Mit einer positiven Bildungsenthalpie von 299,7 kJ·kg−1 bzw. 66,5 kJ·mol−1 handelt es sich um eine endotherme Verbindung.[6][4] Die Kristallstruktur von Hexogen ist orthorhombisch, Raumgruppe Pbca; a=13,22 Å ; b=11,61 Å ; c=10,75 Å ; Z=8.
Die Härte nach Mohs von Hexogen liegt bei 2,5.
Explosionskenngrößen
Hexogen zeigt aufgrund seiner hohen Dichte und hohen Detonationsgeschwindigkeit eine hohe Bilanzleistung und zählt zu den leistungsstarken, hochbrisanten und zudem unempfindlichen sowie chemisch sehr stabilen Sprengmitteln.[4] Wichtige Explosionskennzahlen sind:
- Explosionswärme: 5625 kJ·kg−1 (H2O (l)), 5277 kJ·kg−1 (H2O (g)).[4]
- Normalgasvolumen: 927 l·kg−1.[4]
- Detonationsgeschwindigkeit: 8750 m·s−1 bei der Maximaldichte[4]
- Bleiblockausbauchung: 480 cm3/10 g[4]
- Spezifische Energie: 1370 kJ·kg−1[4]
- Verpuffungspunkt: 230 °C[4]
- Schlagempfindlichkeit: 7,4 N·m[4]
- Reibempfindlichkeit: 120 N Stiftbelastung[4]
- Stahlhülsentest: Grenzdurchmesser 8 mm[4]
Verwendung
Hexogen gilt als besonders starker und hochbrisanter Explosivstoff und ist Bestandteil vieler verbreiteter Sprengstoffarten, zum Beispiel C4 und Torpex.
Hexogen ist in reinem Zustand hochexplosiv. Damit es als Sprengstoff militärisch genutzt werden kann, wird es mit Plastifizierern wie Polyethylen, Wachs, Knetmasse, Vaseline, Polyisobutylen oder Ähnlichem zu den Plastiksprengstoffen A2, A3, B2, B3, B4, C2, C3 und dem am weitesten verbreiteten C4 vermischt. Außerdem bilden die Sprengstoffe Hexogen und PETN zusammen mit einem Plastifizierer den ebenfalls bekannten Plastiksprengstoff Semtex. Wie fast alle militärisch verwendeten Sprengstoffe sind alle diese Plastiksprengstoffe nicht mehr gegen Schlag, Flamme und Reibung empfindlich. Um diese Plastiksprengstoffe zur Explosion zu bringen, muss eine Initialzündung mit einer Sprengkapsel erfolgen. Mit bestimmten anderen chemischen Verbindungen kann Hexogen jedoch auch direkt zur Explosion kommen (siehe Sicherheitshinweise).
Hexogen findet sich in Schneidladungen, wie beispielsweise Linear Cutter. Hier wird durch die partielle Fokussierung der Explosionsenergie ein Durchtrennen von Stahl bis zu 75 mm Stärke ermöglicht[7].
Früher fand Hexogen in Brotteig eingeknetet Verwendung als Rodentizid. Diese Verwendung ist heute aufgrund der strengeren Sprengstoffgesetze nicht mehr gebräuchlich.
Sicherheitshinweise
Hexogen ist ein hochexplosiver Stoff. Oberhalb seines Schmelzpunktes von 200 °C zersetzt es sich unter Bildung von Stickstoffoxiden.
Gefahrenbewertung
Hexogen wurde 2019 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Hexogen waren die Besorgnisse bezüglich Umweltexposition, Exposition von Arbeitnehmern und weit verbreiteter Verwendung sowie der möglichen Gefahren durch krebsauslösende und reproduktionstoxische Eigenschaften. Die Neubewertung soll ab 2020 von Ungarn durchgeführt werden.[8]
Literatur
- J. Gartz: Vom griechischen Feuer zum Dynamit : eine Kulturgeschichte der Explosivstoffe. E.S.Mittler & Sohn, Hamburg 2007, ISBN 978-3-8132-0867-2.
Weblinks
- Toxikologische Bewertung von mit sprengstofftypischen Verbindungen (STV) kontaminierten Grundwasser. Forschungsbericht 1998 des Sächsischen Landesamtes für Umwelt und Geologie, Tabellarische Daten (PDF-Datei; 313 kB)
Einzelnachweise
- Eintrag zu Perhydro-1,3,5-trinitro-1,3,5-triazin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Hexogen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 121-82-4 bzw. Hexogen), abgerufen am 2. November 2015.
- J. Köhler, R. Meyer, A. Homburg: Explosivstoffe. 10., vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7.
- E. S. Domalski, E. D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III. in : J. Phys. Chem. Ref. Data 25, 1996, S. 1–525; doi:10.1063/1.555985.
- M. Delepine, M. Badoche: Thermochimie de l'aldehyde formique, de l'hexamethylene-tetramine et de ses derive. In: C. R. Acad. Sci. Paris. 214, 1942, S. 777–780.
- Sprengung Tagebaugerät "Absetzer 747". 17. September 2018, abgerufen am 31. Juli 2020.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Perhydro-1,3,5-trinitro-1,3,5-triazine, abgerufen am 26. März 2019.


