Helma Wennemers
Helma B. Wennemers (* 24. Juni 1969 in Offenbach am Main) ist eine deutsche organische Chemikerin. Sie ist Professorin für Organische Chemie an der Eidgenössisch Technischen Hochschule in Zürich (ETH Zürich).

Werdegang
Helma Wennemers studierte Chemie an der Universität Frankfurt und schloss 1993 ihre Diplomarbeit bei Gerhard Quinkert ab. 1996 promovierte sie bei W. Clark Still an der Columbia University in New York. Zwischen 1996 und 1998 absolvierte sie einen Postdoktorandenaufenthalt an der Universität Nagoya bei Hisashi Yamamoto, bevor sie 1999 Bachem-Assistenzprofessorin, im Jahr 2003 außerordentliche Professorin an der Universität Basel wurde. 2011 wechselte sie als Professorin für Organische Chemie an die ETH Zürich.
Forschung
Die Forschung von Helma Wennemers konzentriert sich auf bioinspirierte Chemie mit Schwerpunkt auf Prolin-reichen Peptiden.
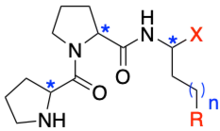
Wennemers entwickelte Tripeptide der Sequenz H-Pro-Pro-Xaa (Pro: Prolin, Xaa: ein beliebiges Amin) als Organokatalysatoren für C–C-Bindungsknüpfungen auf Basis eines Enamin-Mechanismus.[1] Eine hohe Reaktivität, Stereo- und Chemoselektivität für Aldol-[2] oder konjugierte Additionsreaktionen[3][4] kann durch Variation der absoluten Konfiguration der einzelnen Aminosäuren sowie der funktionellen Gruppe des Xaa-Restes erreicht werden. Die Modularität der Peptide ermöglichte die Synthese eines Katalysators, der konjugierte Additionsreaktionen von Aldehyden an Nitroolefine mit nur 0,05 mol% Tripeptid katalysieren kann.[5] Dies ist die niedrigste Katalysatorbeladung einer sekundären Amin katalysierten C–C-Bindungsknüpfung.
Wennemers Forschung konzentriert sich auch auf andere organokatalysierte Transformationen. Inspiriert von natürlichen Polyketidsynthasen, die Malonsäurehalbthioester (MAHTs, z. B. Malonyl-CoA) als Thioester-Enolat-Äquivalente verwenden, entwickelte sie organokatalytische Methoden für stereoselektive Additionsreaktionen von MAHTs (und geschützten Varianten von Monothiomalonaten, MTMs) an Elektrophilen unter Verwendung von Cinchona-Alkaloid-Katalysatoren. Die Verwendung von fluorierten MAHTs und MTMs ermöglichte die stereoselektive Einführung von Fluor-substituenten in Fluoracetat-Aldol-Reaktionen[6] sowie Additionsreaktionen an Imine[7] und Nitroolefine.[8]
Auf dem Gebiet der chemischen Biologie nutzt Wennemers größere Prolin-reiche Peptide wie Kollagen-Modellpeptide oder Oligoproline für Anwendungen wie Tumor-Targeting,[9] Zellpenetration[10] oder gezielter Wirkstofffreisetzung. Wennemers verwendete Cγ-funktionalisierte Prolin-Derivate zur Funktionalisierung und Stabilisierung von kurzkettigen Kollagen-Tripelhelices, dem grundlegenden Strukturbaustein von Kollagen. Ferner führte Wennemers Aminoprolin[11] und γ-Azaprolin[12] als pH-sensitive Sonden ein, um die konformelle Stabilität der Kollagen-Tripelhelix bei verschiedenen pH-Werten zu beeinflussen. Auf dem Gebiet der zellpenetrierenden Peptide zeigte Wennemers, dass die Präorganisation von kationischen Ladungen entlang eines Oligoprolingerüsts die zelluläre Aufnahme von Peptiden in verschiedene Krebszellen (z. B. HeLa) im Vergleich zu flexibleren Oligoargininen mit undefinierter Ladungsverteilung steigert.[10] Diese zellpenetrierenden Peptide auf Oligoprolinbasis zeigen eine definierte Lokalisierung im Zellkern und eine hohe proteolytische Stabilität sowie eine geringe Zytotoxizität.
- Synthetische Materialien:
Wennemers verwendet Peptide, um geordnete mesoskopische Materialien zu erzeugen und deren Morphologie zu steuern. Sie entwickelte Tripeptide zur Synthese von monodispersen, wasserlöslichen Silber-, Palladium-, Platin- und Gold-Nanopartikeln.[13] Kürzlich berichtete Wennemers über peptidstabilisierte Platin-Nanopartikel, die eine höhere Toxizität gegenüber Leberkrebszellen (HepG2) aufweisen als gegenüber anderen Krebszellen und nicht krebsartigen Leberzellen.[14] Darüber hinaus untersucht Wennemers Konjugate von Oligoprolinen und π-konjugierten Systemen, welche Strukturen mit unterschiedlichen Morphologien ausbilden (z. B. Nanofasern, Nanostäbe, Nanoblätter). Mit einem solchen Konjugat gelang es ihr, das erste ausgedehnte, dreiachsige supramolekulare Geflecht herzustellen, das durch Zusammenspiel schwacher nicht-kovalenter Wechselwirkungen zusammengehalten wird – ein bedeutender Beitrag auf dem Gebiet der molekularen Gewebe.[15]
Auszeichnungen
Helma Wennemers wurde unter anderem mit dem Leonidas Zervas Preis der Europäischen Peptid Gesellschaft (2010), dem Pedler Preis der Royal Society of Chemistry (2016), der Inhoffen-Medaille (2017), dem Netherlands Scholar Award for Supramolecular Chemistry (2019) und dem Arthur C. Cope Scholar Award (2020) ausgezeichnet.
Einzelnachweise
- H. Wennemers: In: Chem. Commun. Band 47, 2011, S. 12036–12041.
- P. Krattiger, R. Kovasy, J. D. Revell, S. Ivan, H. Wennemers: In: Org. Lett. Band 7, 2005, S. 1101–1103.
- M. Wiesner, J. D. Revell, H. Wennemers: In: Angew. Chem. Int. Ed. Band 47, 2008, S. 1871–1874.
- M. Wiesner, M. Neuburger, H. Wennemers: In: Chem. Eur. J. Band 15, 2009, S. 10103–10109.
- T. Schnitzer, H. Wennemers: In: J. Am. Chem. Soc. Band 139, 2017, S. 15356–15362.
- J. Saadi, H. Wennemers: In: Nature Chem. Band 8, 2016, S. 276–280.
- E. Cosimi, O. D. Engl, J. Saadi, M.-O. Ebert, H. Wennemers: In: Angew. Chem. Int. Ed. Band 55, 2016, S. 13127–13131.
- E. Cosimi, J. Saadi, H. Wennemers: In: Org. Lett. Band 18, 2016, S. 6014–6017.
- C. Kroll, R. Mansi, F. Braun, S. Dobitz, H. Maecke, H. Wennemers: In: J. Am. Chem. Soc. Band 135, 2013, S. 16793–16796.
- Y. A. Nagel, P. S. Raschle, H. Wennemers: In: Angew. Chem. Int. Ed. Band 56, 2017, S. 122–126.
- C. Siebler, R. S. Erdmann, H. Wennemers: In: Angew. Chem. Int. Ed. Band 53, 2014, S. 10340–10344.
- M. R. Aronoff, J. Egli, M. Menichelli, H. Wennemers: In: Angew. Chem. Int. Ed. Band 58, 2019, S. 3143–3146.
- S. Corra, M. S. Shoshan, H. Wennemers: In: Curr. Opin., Chem. Biol. Band 40, 2017, S. 138–144.
- M. S. Shoshan, T. Vonderach, B. Hattendorf, H. Wennemers: In: Angew. Chem. Int. Ed. Band 58, 2019, S. 4901–4905.
- U. Lewandowska, W. Zajaczkowski, S. Corra, J. Tanabe, R. Borrmann, E. M. Benetti, S. Stappert, K. Watanabe, N. A. K. Ochs, R. Schaeublin, C. Li, E. Yashima, W. Pisula, K. Müllen, H. Wennemers: In: Nat. Chem. Band 9, 2017, S. 1068–1072.