Glucose-6-phosphat-Isomerase
Glucose-6-phosphat-Isomerase (GPI) (auch Phosphohexose-Isomerase oder Phosphoglucose-Isomerase, PGI) heißt dasjenige Enzym der Glycolyse, das die Umwandlung von Glucose-6-phosphat (G6P) in Fructose-6-phosphat (F6P) katalysiert. Diese Reaktion ist für alle Lebewesen unentbehrlich, um die Energie in Kohlenhydraten zu verwerten. Außerdem ist die Reaktion umkehrbar, und die umgekehrte Reaktion wird für die Gluconeogenese benötigt. Mutationen am GPI-Gen, das auf Chromosom 19 codiert ist, können Ursache für GPI-Mangel, und dieser verantwortlich für hämolytische Anämie oder schwerere Störungen bereits beim Neugeborenen sein. Nach neuen Untersuchungen ist GPI ein Faktor im Krankheitsgeschehen bei Arthritis und Tumor.[1] Die GPI ist nicht identisch mit der D-Xylose-Isomerase aus dem Abbau von Stärke.
| Glucose-6-phosphat-Isomerase | ||
|---|---|---|
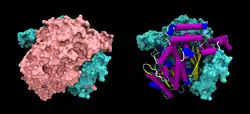 | ||
| Oberflächenmodell des G6PI-Dimer, rechts eine Untereinheit als Cartoon, nach PDB 1JIQ | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 557 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Name | GPI | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 5.3.1.9, Isomerase | |
| Reaktionsart | Umlagerung | |
| Substrat | D-Glucose-6-phosphat; D-Fructose-6-phosphat | |
| Produkte | D-Fructose-6-phosphat; D-Glucose-6-phosphat | |
| Vorkommen | ||
| Homologie-Familie | CLU_017947_3_0 | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 2821 | 14751 |
| Ensembl | ENSG00000282019 | ENSMUSG00000036427 |
| UniProt | P06744 | P06745 |
| Refseq (mRNA) | NM_000175 | NM_008155 |
| Refseq (Protein) | NP_000166 | NP_032181 |
| Genlocus | Chr 19: 34.36 – 34.4 Mb | Chr 7: 34.2 – 34.23 Mb |
| PubMed-Suche | 2821 | 14751 |
Struktur
Funktionales GPI ist ein Dimer mit einer Molekülmasse von 64 kDa, das aus zwei identischen Monomeren besteht.[2][3] Die beiden Monomere interagieren insbesondere durch die beiden Vorwölbungen in einer engen Verankerung. Das aktive Zentrum jedes Monomers wird durch einen Spalt zwischen den beiden Domänen und der Dimergrenzfläche gebildet.[2]
GPI-Monomere bestehen aus zwei Domänen, von denen eine aus zwei separaten Segmenten besteht, die als große Domäne bezeichnet werden und die andere Domäne aus dem dazwischen liegenden Segment, der kleinen Domäne.[4] Die beiden Domänen sind jeweils αβα-Sandwiches, wobei die kleine Domäne ein fünfsträngiges β-Faltblatt enthält, das von α-Helices umgeben ist, während die große Domäne ein sechssträngiges β-Faltblatt enthält.[2] Die große Domäne, die sich am N-Terminus und am C-Terminus jedes Monomers befindet, enthält auch „armartige“ Vorsprünge.[5]
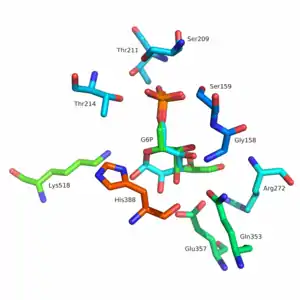
Mehrere Reste in der kleinen Domäne dienen zur Bindung von Phosphat, während andere Reste, insbesondere His388, aus der großen und der C-terminalen Domäne für den durch dieses Enzym katalysierten Schritt der Zuckerringöffnung entscheidend sind. Da die Isomerisierungsaktivität an der Dimergrenzfläche auftritt, ist die Dimerstruktur dieses Enzyms für seine katalytische Funktion entscheidend.[5]
Es wird vermutet, dass die Serinphosphorylierung dieses Proteins eine Konformationsänderung seiner sekretorischen Form hervorruft.[3]
Eigenschaften
Das Protein hat verschiedene Funktionen innerhalb und außerhalb der Zelle. Im Cytoplasma ist das Protein an der Glykolyse, der Gluconeogenese und dem Pentosephosphatweg beteiligt.[5] Außerhalb der Zelle fungiert es als neurotropher Faktor für spinale und sensorische Neuronen, genannt Neuroleukin.[6] Dasselbe Protein wird auch von Krebszellen ausgeschieden, wo es als autokriner Motilitätsfaktor (AMF)[7] bezeichnet wird und die Metastase stimuliert.[8] Es ist auch bekannt, dass extrazelluläre GPI als Reifungsfaktor fungiert.[5][6] Nachdem belegt wurde, dass GPI identisch mit dem autokrinen Motilitätsfaktor und mit Neuroleukin ist, können weitere Funktionen des GPI-Proteins genannt werden.
Als neurotrophischer Faktor begünstigt es das Wachstum und die Differenzierung von Spinal- und sensorischen Neuronen.[9] Es kommt in großen Mengen in Muskeln, Gehirn, Herz und Nieren vor.[10] Neuroleukin wirkt auch als Lymphokin, das von durch Lectin stimulierten T-Zellen ausgeschieden wird. Es induziert die Sekretion von Immunglobulin in B-Zellen als Teil einer Reaktion, die Antikörper-sezernierende Zellen aktiviert.[11]
Als AMF aktiviert es den AMF-Rezeptor (AMFR). Auf fortgeschrittenen Tumorzellen wurde eine erhöhte Anzahl dieser Rezeptoren festgestellt. AMF wird von Krebszellen produziert und sezerniert, und stimuliert das Zellwachstum und die Beweglichkeit als Wachstumsfaktor.[12] Es wird angenommen, dass AMF eine Schlüsselrolle bei der Krebsmetastase spielt, indem es die MAPK/ERK- oder PI3K/AKT-Signalwege aktiviert.[13][14] Im PI3K/AKT-Signalweg interagiert AMF mit dem gp78/AMFR-Komplex, um die Calciumfreisetzung im endoplasmatischen Retikulum (ER) zu regulieren und schützt daher vor Apoptose als Reaktion auf ER-Stress.[13] Aktivierung des AMFR beeinflusst die zelluläre Adhäsion, Motilität, Sprossung und Apoptose.[15]
In einigen Archaeen und Bakterien tritt die Glucose-6-phosphat-Isomerase-Aktivität über ein bifunktionelles Enzym auf, das auch Mannose-6-phosphat-Isomerase-Aktivität (PMI-Aktivität) aufweist. Obwohl es nicht eng mit eukaryotischen GPI verwandt ist, ist das bifunktionelle Enzym ähnlich genug, dass die Sequenz den Cluster von Threonin- und Serinresten enthält, der die Zuckerphosphat-Bindungsstelle bei herkömmlichem GPI bildet. Es wird angenommen, dass das Enzym die gleichen katalytischen Mechanismen für die Glucose-Ringöffnung und die Isomerisierung für die Umwandlung von Glucose-6-phosphat in Fructose-6-phosphat verwendet.[16]
Mechanismus
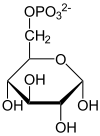
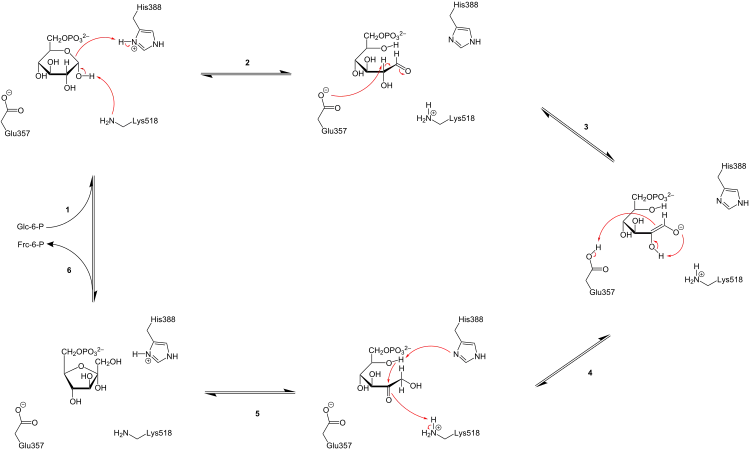
Der GPI-Mechanismus zur Umwandlung von Glucose-6-phosphat (Aldose) zu Fructose-6-phosphat (Ketose) besteht aus drei Hauptschritten: Öffnen des Glucose-Rings, Isomerisierung von Glucose zu Fructose über ein Endiolat-Intermediat und Schließen des Fructose-Rings.[17]
 ⇔
⇔ 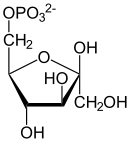
- Glucose-6-phosphat wird zu Fructose-6-phosphat umgelagert und umgekehrt.
Glucose-6-phosphat bindet in seiner Pyranoseform an GPI (1). Der Ring wird durch einen push-pull-Mechanismus von His388, der den C5-Sauerstoff protoniert, und Lys518, der die C1-Hydroxygruppe deprotoniert, geöffnet, weshalb dieser Schritt auch als säurekatalysierte Ringöffnung bezeichnet wird (2). Dadurch entsteht eine offene Aldose. Dann wird das Substrat um die C3-C4-Bindung gedreht, um es für die Isomerisierung zu positionieren. In diesem Moment deprotoniert Glu357 das C2-Atom unter Bildung eines durch Arg272 stabilisierten cis-Endiolat-Intermediats (Basenkatalyse, 3). Zur Vervollständigung der Isomerisierung spendet Glu357 sein Proton, was vorher mit einem Proton der umgebenden Lösung ausgetauscht wurde,[18] an das C1-Atom, die C2-Hydroxygruppe verliert ihr Proton und es entsteht das offenkettige Fructose-6-phosphat (Säurekatalyse, 4). Schließlich wird der Ring geschlossen, indem das Substrat erneut um die C3-C4-Bindung gedreht und die C5-Hydroxygruppe durch His388 deprotoniert wird, weshalb dieser Schritt auch als basenkatalysierte Ringschließung bezeichnet wird (5).[19] Anschließend verlässt das gebildete Produkt (Fructose-6-phosphat in seiner Pyranoseform) das aktive Zentrum der Glucose-6-phosphat-Isomerase (6).
Pathologie
Neben den aus GPI-Mangel resultierenden erblichen Stoffwechselstörungen ist eine Form von Arthritis bekannt, die als Ursache Autoimmunität gegen GPI hat. Inzwischen weiß man, dass IL-6 und TH17 eine Rolle beim Erwerb dieser Krankheit spielen.[20]
Erhöhte GPI-Werte im Serum wurden als prognostischer Biomarker für Darm-, Brust-, Lungen-, Nieren-, Magen-, Darm- und andere Krebsarten verwendet.[3][6] Als AMF wird GPI die Regulation der Zellmigration während der Invasion und Metastase zugeschrieben.[3] Eine Studie zeigte, dass die äußeren Schichten von Brusttumor-Sphäroiden (BTS) GPI absondern, was die Epithelial-mesenchymale Transition (EMT), die Invasion und die Metastase bei BTS induziert. Es wurde festgestellt, dass die GPI-Inhibitoren ERI4P und 6PG die Metastase von BTS blockieren, nicht jedoch die BTS-Glykolyse oder die Lebensfähigkeit von Fibroblasten. Außerdem wird GPI ausschließlich von Tumorzellen und nicht von normalen Zellen sezerniert. Aus diesen Gründen könnten GPI-Inhibitoren ein sicherer und zielgerichteterer Ansatz für die Krebstherapie sein.[21]
GPI beteiligt sich auch an einer positiven Rückkopplungsschleife mit HER2, einem wichtigen Target für Brustkrebs, da GPI die HER2-Expression und HER2-Überexpression die GPI-Expression erhöht und so weiter. Infolgedessen führt die GPI-Aktivität wahrscheinlich zu einer Resistenz von Brustkrebszellen gegen HER2-basierte Therapien mit Trastuzumab (Handelsname: Herceptin®) und sollte bei der Behandlung von Patienten als zusätzliches Target betrachtet werden.[22]
Weblinks
Einzelnachweise
- UniProt P06744
- C. J. Jeffery, B. J. Bahnson, W. Chien, D. Ringe, G. A. Petsko: Crystal structure of rabbit phosphoglucose isomerase, a glycolytic enzyme that moonlights as neuroleukin, autocrine motility factor, and differentiation mediator. In: Biochemistry. Band 39, Nummer 5, Februar 2000, S. 955–964, doi:10.1021/bi991604m, PMID 10653639.
- A. Haga, Y. Niinaka, A. Raz: Phosphohexose isomerase/autocrine motility factor/neuroleukin/maturation factor is a multifunctional phosphoprotein. In: Biochimica et Biophysica Acta. Band 1480, Nummer 1–2, Juli 2000, S. 235–244, doi:10.1016/s0167-4838(00)00075-3, PMID 11004567.
- Y. J. Sun, C. C. Chou, W. S. Chen, R. T. Wu, M. Meng, C. D. Hsiao: The crystal structure of a multifunctional protein: phosphoglucose isomerase/autocrine motility factor/neuroleukin. In: Proceedings of the National Academy of Sciences. Band 96, Nummer 10, Mai 1999, S. 5412–5417, doi:10.1073/pnas.96.10.5412, PMID 10318897, PMC 21873 (freier Volltext).
- A. T. Cordeiro, P. H. Godoi, C. H. Silva, R. C. Garratt, G. Oliva, O. H. Thiemann: Crystal structure of human phosphoglucose isomerase and analysis of the initial catalytic steps. In: Biochimica et Biophysica Acta. Band 1645, Nummer 2, Februar 2003, S. 117–122, doi:10.1016/s1570-9639(02)00464-8, PMID 12573240.
- S. Somarowthu, H. R. Brodkin, J. A. D'Aquino, D. Ringe, M. J. Ondrechen, P. J. Beuning: A tale of two isomerases: compact versus extended active sites in ketosteroid isomerase and phosphoglucose isomerase. In: Biochemistry. Band 50, Nummer 43, November 2011, S. 9283–9295, doi:10.1021/bi201089v, PMID 21970785.
- Y. Dobashi, H. Watanabe, Y. Sato, S. Hirashima, T. Yanagawa, H. Matsubara, A. Ooi: Differential expression and pathological significance of autocrine motility factor/glucose-6-phosphate isomerase expression in human lung carcinomas. In: The Journal of pathology. Band 210, Nummer 4, Dezember 2006, S. 431–440, doi:10.1002/path.2069, PMID 17029220.
- H. Watanabe, K. Takehana, M. Date, T. Shinozaki, A. Raz: Tumor cell autocrine motility factor is the neuroleukin/phosphohexose isomerase polypeptide. In: Cancer Research. Band 56, Nummer 13, Juli 1996, S. 2960–2963, PMID 8674049.
- Glucose-6-phosphat-Isomerase. In: Online Mendelian Inheritance in Man. (englisch).
- M. E. Gurney, S. P. Heinrich, M. R. Lee, H. S. Yin: Molecular cloning and expression of neuroleukin, a neurotrophic factor for spinal and sensory neurons. In: Science. Band 234, Nummer 4776, Oktober 1986, S. 566–574, doi:10.1126/science.3764429, PMID 3764429.
- M. E. Gurney, B. R. Apatoff, G. T. Spear, M. J. Baumel, J. P. Antel, M. B. Bania, A. T. Reder: Neuroleukin: a lymphokine product of lectin-stimulated T cells. In: Science. Band 234, Nummer 4776, Oktober 1986, S. 574–581, doi:10.1126/science.3020690, PMID 3020690.
- S. Silletti, A. Raz: Autocrine motility factor is a growth factor. In: Biochemical and biophysical research communications. Band 194, Nummer 1, Juli 1993, S. 446–457, doi:10.1006/bbrc.1993.1840, PMID 8392842.
- M. Fu, L. Li, T. Albrecht, J. D. Johnson, L. D. Kojic, I. R. Nabi: Autocrine motility factor/phosphoglucose isomerase regulates ER stress and cell death through control of ER calcium release. In: Cell death and differentiation. Band 18, Nummer 6, Juni 2011, S. 1057–1070, doi:10.1038/cdd.2010.181, PMID 21252914, PMC 3131941 (freier Volltext).
- L. A. Liotta, R. Mandler, G. Murano, D. A. Katz, R. K. Gordon, P. K. Chiang, E. Schiffmann: Tumor cell autocrine motility factor. In: Proceedings of the National Academy of Sciences. Band 83, Nummer 10, Mai 1986, S. 3302–3306, doi:10.1073/pnas.83.10.3302, PMID 3085086, PMC 323501 (freier Volltext).
- C. G. Chiu, P. St-Pierre, I. R. Nabi, S. M. Wiseman: Autocrine motility factor receptor: a clinical review. In: Expert review of anticancer therapy. Band 8, Nummer 2, Februar 2008, S. 207–217, doi:10.1586/14737140.8.2.207, PMID 18279062 (Review).
- M. K. Swan, T. Hansen, P. Schönheit, C. Davies: A novel phosphoglucose isomerase (PGI)/phosphomannose isomerase from the crenarchaeon Pyrobaculum aerophilum is a member of the PGI superfamily: structural evidence at 1.16-A resolution. In: Journal of Biological Chemistry. Band 279, Nummer 38, September 2004, S. 39838–39845, doi:10.1074/jbc.M406855200, PMID 15252053.
- J. Read, J. Pearce, X. Li, H. Muirhead, J. Chirgwin, C. Davies: The crystal structure of human phosphoglucose isomerase at 1.6 A resolution: implications for catalytic mechanism, cytokine activity and haemolytic anaemia. In: Journal of molecular biology. Band 309, Nummer 2, Juni 2001, S. 447–463, doi:10.1006/jmbi.2001.4680, PMID 11371164.
- Donald Voet, Judith G. Voet, Charlotte W. Pratt: Fundamentals of Biochemistry. Life at the Molecular Level. 5. Auflage. John Wiley & Sons, Hoboken, NJ 2016, ISBN 978-1-118-91840-1, S. 484 (eingeschränkte Vorschau in der Google-Buchsuche).
- J. T. Solomons, E. M. Zimmerly, S. Burns, N. Krishnamurthy, M. K. Swan, S. Krings, H. Muirhead, J. Chirgwin, C. Davies: The crystal structure of mouse phosphoglucose isomerase at 1.6A resolution and its complex with glucose 6-phosphate reveals the catalytic mechanism of sugar ring opening. In: Journal of molecular biology. Band 342, Nummer 3, September 2004, S. 847–860, doi:10.1016/j.jmb.2004.07.085, PMID 15342241.
- K. Iwanami, I. Matsumoto, Y. Tanaka-Watanabe, A. Inoue, M. Mihara, Y. Ohsugi, M. Mamura, D. Goto, S. Ito, A. Tsutsumi, T. Kishimoto, T. Sumida: Crucial role of the interleukin-6/interleukin-17 cytokine axis in the induction of arthritis by glucose-6-phosphate isomerase. In: Arthritis and rheumatism. Band 58, Nummer 3, März 2008, S. 754–763, doi:10.1002/art.23222, PMID 18311788.
- J. C. Gallardo-Pérez, N. A. Rivero-Segura, A. Marín-Hernández, R. Moreno-Sánchez, S. Rodríguez-Enríquez: GPI/AMF inhibition blocks the development of the metastatic phenotype of mature multi-cellular tumor spheroids. In: Biochimica et Biophysica Acta. Band 1843, Nummer 6, Juni 2014, S. 1043–1053, doi:10.1016/j.bbamcr.2014.01.013, PMID 24440856.
- D. H. Kho, P. Nangia-Makker, V. Balan, V. Hogan, L. Tait, Y. Wang, A. Raz: Autocrine motility factor promotes HER2 cleavage and signaling in breast cancer cells. In: Cancer Research. Band 73, Nummer 4, Februar 2013, S. 1411–1419, doi:10.1158/0008-5472.CAN-12-2149, PMID 23248119, PMC 3577983 (freier Volltext).