Ethinylestradiol
Ethinylestradiol ist ein synthetischer Arzneistoff aus der Gruppe der Estrogene. Es ist ein Derivat des natürlich vorkommenden Estradiols mit verstärkter estrogener Wirkung und wird vor allem zur Empfängnisverhütung eingesetzt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
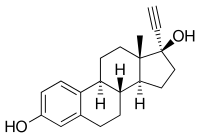 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Ethinylestradiol (INN) | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C20H24O2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis schwach gelblichweißes kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 296,40 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
fast unlöslich in Wasser, gut löslich in verschiedenen organischen Lösungsmitteln[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Pharmakologische Eigenschaften
Ethinylestradiol wirkt wie Estradiol als Agonist an den im Zellinneren vorkommenden Estrogenrezeptoren. Die zusätzliche Ethinylgruppe am C-17 beeinflusst insbesondere die pharmakokinetischen Eigenschaften: So unterliegt Ethinylestradiol im Vergleich zum Estradiol einem deutlich verminderten First-Pass-Effekt in der Leber, mit der Folge einer deutlich erhöhten oralen Bioverfügbarkeit.[5]
Klinische Angaben
Anwendungsgebiete (Indikationen)
Ethinylestradiol wird vor allem zur Empfängnisverhütung eingesetzt und dient hier zusammen mit einem Gestagen als typischer Inhaltsstoff von kombinierten oralen Kontrazeptiva (Antibabypille). Weitere Anwendungsgebiete sind die Hormonersatztherapie, die palliative Behandlung bei Prostatakrebs sowie verschiedene Menstruationsstörungen, wie beispielsweise die primäre und sekundäre Amenorrhoe.[6][7]
Dosierung
Bei einer typischen Antibabypille beträgt die täglich zugeführte Ethinylestradiol-Dosis heute 20 bis 35 Mikrogramm.[6] In den 1960er Jahren waren noch Dosierungen von 50 bis 100 Mikrogramm üblich.[5]
Gegenanzeigen (Kontraindikationen)
Bei folgenden Erkrankungen – akut vorliegend, oder auch in der Vorgeschichte – sollten Ethinylestradiol-haltige Präparate nicht eingesetzt werden (Auswahl):[6][8]
- Erkrankungen der Leber, insbesondere Lebertumoren
- Estrogenabhängige Tumoren von Gebärmutter und Brustdrüse
- schwer behandelbare Hypertriglyceridämie
- Pankreatitis
- Thromboembolische Erkrankungen
- ungeklärte vaginale Blutungen
- Schwer einstellbare arterielle Hypertonie (Bluthochdruck)
- Diabetes mellitus mit Gefäßveränderungen
- Migräne mit fokalen neurologischen Symptomen
Anwendung während Schwangerschaft und Stillzeit
Für die Anwendung von Ethinylestradiol in der Schwangerschaft besteht keine Indikation. In der Stillzeit ist zu beachten, dass Ethinylestradiol in die Muttermilch übertreten und auch deren Bildung mindern kann.[6]
Wechselwirkungen mit anderen Medikamenten
Aufgrund seiner pharmakokinetischen Eigenschaften unterliegt Ethinylestradiol vielfältigen Arzneimittelwechselwirkungen. An erster Stelle zu nennen sind hier Interaktionen mit Enzyminduktoren des Cytochrom-P450-Enzymsystems. Ethinylestradiol wird v. a. durch CYP3A4 in der Leber metabolisiert. Verschiedene Arzneistoffe zur Behandlung der Epilepsie (Antikonvulsiva) wie Barbiturate, Carbamazepin, Phenytoin oder Primidon, aber auch das Antiinfektivum Rifampicin oder das pflanzliche Antidepressivum Johanniskraut verstärken die Ausprägung dieses Enzyms, erhöhen somit den Stoffwechsel von Ethinylestradiol, und vermindern – bei Anwendung als Bestandteil der Antibabypille – die empfängnisverhütende Wirkung.[9]
Ethinylestradiol unterliegt teilweise einem enterohepatischen Kreislauf. Konjugate mit Glucuronsäure oder Sulfat gelangen mit der Gallenflüssigkeit in den Darm. Dort werden sie zum Teil durch die Darmflora gespalten, das ungebundene Ethinylestradiol kann erneut absorbiert werden und länger wirken. Bei gleichzeitiger Einnahme von Antibabypillen mit Tetracyclinen und verschiedenen Penicillinen sind erniedrigte Ethinylestradiol-Plasmaspiegel beobachtet worden.[6] Es ist ungeklärt, ob dies tatsächlich auf eine Beeinträchtigung des enterohepatischen Kreislaufs zurückzuführen ist.[8]
Unerwünschte Wirkungen (Nebenwirkungen)
Zu den häufigsten Nebenwirkungen nach der Einnahme von Ethinylestradiol (in oralen Kontrazeptiva) zählen Brustschmerzen und eine gesteigerte Empfindlichkeit der Brust, Gewichtsveränderungen, Akne, Stimmungsschwankungen sowie Vaginitis. Gelegentlich kommt es zu Veränderungen des Appetits, Bauchkrämpfen oder Ausschlag. Durch die Beachtung der Kontraindikationen soll das Auftreten der schwerwiegendsten Nebenwirkungen wie Thromboembolien sowie Krebserkrankungen von Leber, Gebärmutterhals und Brustdrüse minimiert werden.[8]
Sonstige Informationen
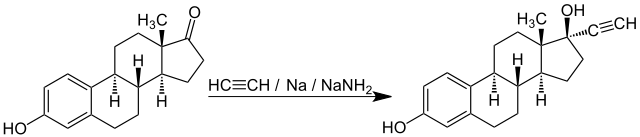
Chemische Informationen
Ethinylestradiol kann durch Einführung einer Ethinylgruppe in der Position 17 von Estron synthetisiert werden.[10] Der 3-Methylether des Ethinylestradiols, das Mestranol, ist ein weiteres synthetisches Estrogen, das jedoch nur noch selten verwendet wird.
Umweltwirkungen
Wie Frauke Hoffmann und Werner Kloas vom Leibniz-Institut für Gewässerökologie und Binnenfischerei in Tierversuchen gezeigt haben, verändern schon geringste Mengen (ng bis µg/l Umgebungswasser) von Ethinylestradiol das Balzverhalten von Afrikanischen Krallenfröschen (Xenopus laevis) merklich. Die Anzahl der Rufe und Klicklaute verringert sich signifikant, wodurch sich auch die Attraktivität der Männchen für die Weibchen verringert. Dadurch steigt auch das Risiko einer Paarungsverweigerung. Da Ethinylestradiol teilweise über den Urin wieder ausgeschieden wird, gelangt es über Abwässer in Freilandgewässer, wo es sich tatsächlich in den untersuchten Konzentrationen wiederfindet. Ethinylestradiol könnte somit also einen Beitrag zum weltweiten Amphibiensterben leisten.[11]
Bei ähnliches Konzentration wurden Änderungen im Verhalten, der Reproduktion, im Geschlechterverhältnis und der embryonalen Entwicklung von aquatischen Organismen beobachtet.[12]
Geschichte
Die Entwicklung von Ethinylestradiol erfolgte 1938 durch Hans Herloff Inhoffen und Walter Hohlweg bei der Berliner Schering AG (heute Bayer HealthCare Pharmaceuticals).[13]
Handelsnamen
aida (D), Asumate (D), Balanca (D, A), Belara (D, A, CH), Bellgyn (A), Bellissima (D), Biviol (D), Chariva, Cilest (D, CH), Cileste (A), Clevia (D), Conceplan (D), Desmin (D), Diane (D, A, CH), Elleacnelle (CH), Eve (D), Evra (D, CH), Femigoa (D), Femigyne (D), Femovan (D), Gabrielle (D), Gracial (A, CH), Gravistat (D), Harmonet (CH), Illina (D), Lamuna (D), Larissa Gynial (A), Leios (D), Leona (D), Levomin (D), Lovelle (D), madinette (D), Marvelon (D, A, CH), Maxim (D), Microgynon (D), Minisiston (D), Minulet (D, A, CH), Miranova (D), Mirelle(A), Monahexal (D), MonoStep (D), Neo-Eunomin (D), NovaStep (D), Novial (D), NuvaRing (D, CH), Ovysmen (A), Petibelle (D), Pramino (D), Selina mite Gynial (A), Swingo (D), Synphasec (D), Trigoa (D), TriNovum (D, A), Triquilar (D), Trisiston (D), Valette (D), Yasmin (D, A, CH), Yasminelle (D), Yaz (D)
Einzelnachweise
- Europäisches Arzneibuch. Nachtrag 2001. Deutscher Apotheker Verlag, 2002, ISBN 3-7692-2768-9.
- C. Hunnius (Begr.), H. P. T. Ammon (Hrsg.): Hunnius pharmazeutisches Wörterbuch. 9., neu bearb. und erw. Auflage. de Gruyter, Berlin/ New York 2004, ISBN 3-11-017475-8.
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station, NJ, USA, 2006, ISBN 0-911910-00-X, S. 641.
- Datenblatt 17α-Ethynylestradiol bei Sigma-Aldrich, abgerufen am 31. März 2011 (PDF).
- L. L. Brunton, J. S. Lazo, K. Parker (Hrsg.): Goodman and Gilman's the Pharmacological Basis of Therapeutics. 11. Auflage, B&T Verlag, ISBN 978-0-07-142280-2.
- Rote Liste Online. Abgerufen am 2. August 2008.
- Fachinformation eines Ethinylestradiol-Monopräparats (englisch). Abgerufen am 3. Dezember 2013.
- BfArM-Musterfachinformation für Ethinylestradiol-Levonorgestrel-Kombinationspräparate. (RTF; 156 kB) Abgerufen am 13. August 2008.
- I. H. Stockley (Hrsg.): Stockley's Drug interactions. 6. Auflage. Pharmaceutical Press, London/ Grayslake, ISBN 0-85369-504-0.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher, Dieter Reichert: Pharmaceutical Substances. 5. Auflage. Thieme-Verlag, Stuttgart 2009, ISBN 978-3-13-558405-8, S. 522–523; zusätzlich online mit halbjährlichen Ergänzungen und Aktualisierungen.
- Frank Schubert: Wirkstoff von Antibabypillen lässt Frösche weniger flirten. In: Spektrum der Wissenschaft. Spektrum der Wissenschaft Verlagsgesellschaft, Heidelberg Juni 2012.
- Umweltbundesamt: Maßnahmen zur Verminderung des Eintrages von Mikroschadstoffen in die Gewässer – Phase 2 (p.69), Dessau-Roßlau Juni 2016.
- bayerpharma.com: Meilensteine der Firmengeschichte (Memento des Originals vom 7. März 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.