Carvon
Carvon (Betonung auf der Endsilbe: Carvon) ist ein monocyclisches Monoterpen-Keton und Bestandteil von ätherischen Ölen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
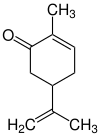 | ||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Carvon | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C10H14O | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 150,22 g·mol−1 | |||||||||||||||
| Aggregatzustand | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vertreter
Es gibt zwei enantiomere Carvone, das (S)-(+)-Carvon [auch als D-(+)-Carvon oder kurz (+)-Carvon bezeichnet] sowie das (R)-(−)-Carvon [auch als L-(−)-Carvon oder kurz (−)-Carvon bezeichnet].
| Enantiomere von Carvon | ||
| Name | (S)-(+)-Carvon | (R)-(−)-Carvon |
| Andere Namen | D-(+)-Carvon | L-(−)-Carvon |
| Strukturformel | -(%252B)-Carvone_Structural_Formula_V.svg.png.webp) |
-(%E2%80%93)-Carvone_Structural_Formula_V.svg.png.webp) |
| CAS-Nummer | 2244-16-8 | 6485-40-1 |
| 99-49-0 (Racemat) | ||
| EG-Nummer | 218-827-2 | 229-352-5 |
| 202-759-5 (Racemat) | ||
| ECHA-Infocard | 100.017.117 | 100.026.684 |
| 100.002.508 (Racemat) | ||
| PubChem | 16724 | 439570 |
| 7439 (Racemat) | ||
| FL-Nummer | 07.146 | 07.147 |
| 07.012 (Racemat) | ||
| Wikidata | Q27889969 | Q27089417 |
| Q416800 (Racemat) | ||
| Kurzbeschreibung | farbloses Öl, charakteristischer Geruch nach Kümmel | farbloses Öl, charakteristischer Geruch nach Minze |
| Siedepunkt | 228–230 °C[2] | 230–231 °C[3] |
| Löslichkeit | schwer in Wasser (1300 mg/l bei 18 °C)[2] | praktisch unlöslich in Wasser (20 °C)[3] |
| LD50 | 3,71 ml·kg−1 (Ratte, peroral)[5] | 1640 mg·kg−1 (Ratte, peroral)[6] |
Vorkommen
In der Natur treten beide enantiomere Formen des Carvons auf. So ist (S)-(+)-Carvon enthalten in Kümmelöl (ca. 85 %),[7] Dill[8][7] und Mandarinenschalen. Das (R)-Enantiomer findet sich in den ätherischen Ölen von Krauseminze[9][7] und Kuromoji. Das Ingwergrasöl enthält beide enantiomeren Formen des Carvons (Racemat).[7]
 Echter Kümmel
Echter Kümmel Rossminze (Mentha longifolia)
Rossminze (Mentha longifolia)
Herstellung
(S)-(+)-Carvon gewinnt man durch Wasserdampfdestillation von Kümmel und Extraktion des Destillats.
Eigenschaften
Wie alle chiralen Duftstoffe weist auch Carvon unterschiedliche Geruchstypen seiner Enantiomere auf.[10][11] Das (S)-(+)-Carvon weist einen Kümmelgeruch auf, sein Spiegelbild (R)-(−)-Carvon riecht nach Krauseminze. Carvon wirkt keimhemmend.[12]
Analytik
Die qualitative und quantitative Bestimmung der Carvone gelingt nach adäquater Probenvorbereitung durch Kopplung der Kapillargaschromatographie und HPLC mit der Massenspektrometrie.[13]
Verwendung
Carvon wird als Ausgangsverbindung in der Naturstoffsynthese sowie bei der Herstellung von Likören, Kosmetik und Seife verwendet.[7]
Sicherheitshinweise
(R)-(−)-Carvon ist allergieauslösend.[14]
Weblinks
- Sicherheitsdatenblätter für (S)-(+)-Carvon:
- Datenblatt (S)-(+)-Carvon (PDF) bei Carl Roth, abgerufen am 8. Januar 2008.
- Datenblatt (S)-(+)-Carvon (PDF) bei Merck, abgerufen am 8. Januar 2008.
- Sicherheitsdatenblätter für (R)-(−)-Carvon:
- Datenblatt (R)-(−)-Carvon (PDF) bei Carl Roth, abgerufen am 8. Januar 2008.
- Datenblatt (R)-(−)-Carvon (PDF) bei Merck, abgerufen am 8. Januar 2008.
Einzelnachweise
- Eintrag zu Carvone bei Toronto Research Chemicals, abgerufen am 27. Januar 2022 (PDF).
- Eintrag zu (S)-2-Methyl-5-(1-methylethenyl)cyclohex-2-en-1-on in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Mai 2017. (JavaScript erforderlich)
- Eintrag zu (R)-2-Methyl-5-(1-methylethenyl)cyclohex-2-en-1-on in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Mai 2017. (JavaScript erforderlich)
- Eintrag zu d-carvone im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 17. Juni 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu d-Carvone in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 1. April 2017.
- Eintrag zu (-)-Carvone in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 1. April 2017.
- Eintrag zu Carvon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. Dezember 2021.
- Birgit Faber, Kerstin Bangert, Armin Mosandl: GC-IRMS and enantioselective analysis in biochemical studies in dill (Anethum graveolens L.). In: Flavour and Fragrance Journal. Band 12, Nr. 5, September 1997, S. 305–309, doi:10.1002/(SICI)1099-1026(199709/10)12:5<305::AID-FFJ659>3.0.CO;2-7.
- Valtcho D. Zheljazkov, Charles L. Cantrell, Tess Astatkie, M. Wayne Ebelhar: Productivity, Oil Content, and Composition of Two Spearmint Species in Mississippi. In: Agronomy Journal. Band 102, Nr. 1, Januar 2010, S. 129–133, doi:10.2134/agronj2009.0258.
- G. F. Russel, J. I. Hills: Odor Differences between Enantiomeric Isomers. In: Science. 172, 1971, S. 1043–1044; doi:10.1126/science.172.3987.1043.
- L. Friedmann, J. G. Miller: Odor Incongruity and Chirality. In: Science. 172, 1971, S. 1044–1046; doi:10.1126/science.172.3987.1044.
- Kartoffeln (Solanum tuberosum) – Nahrung.
- C. Barba, R. M. Martínez, M. M. Calvo, G. Santa-María, M. Herraiz: Chiral analysis by online coupling of reversed-phase liquid chromatography to gas chromatography and mass spectrometry. In: Chirality. 24(5), Mai 2012, S. 420–426, PMID 22517436.
- A. T. Karlberg, K. Magnusson, U. Nilsson: Air oxidation of d-limonene (the citrus solvent) creates potent allergens. In: Contact Dermatitis. 26 (5), 1992, S. 332–340, PMID 1395597.
