Clostridioides difficile
Clostridioides difficile (bis August 2016 Clostridium difficile) ist ein anaerobes, grampositives, endosporenbildendes Stäbchenbakterium, welches zur Gattung Clostridioides sensu lato gehört. C. difficile ist einer der häufigsten nosokomialen Erreger, sogenannter Krankenhauskeime.
| Clostridioides difficile | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
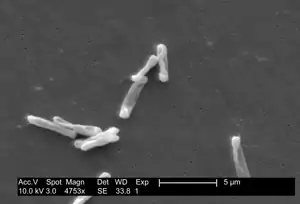
Elektronenmikroskopisches Bild von Clostridioides difficile | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Clostridioides difficile | ||||||||||||
| (Hall & O’Toole 1935) Prévot 1938 |
| Klassifikation nach ICD-10-GM | |
|---|---|
| A04.79 | Enterokolitis durch Clostridium difficile, nicht näher bezeichnet |
| A04.70 | Enterokolitis durch Clostridium difficile ohne Megakolon, ohne sonstige Organkomplikationen |
| A04.71 | Enterokolitis durch Clostridium difficile ohne Megakolon, mit sonstigen Organkomplikationen |
| A04.72 | Enterokolitis durch Clostridium difficile mit Megakolon, ohne sonstige Organkomplikationen |
| A04.73 | Enterokolitis durch Clostridium difficile mit Megakolon, mit sonstigen Organkomplikationen |
| U69.4! | Rekurrente Infektion mit Clostridium difficile[1] |
| ICD-10 online (GM-Version 2021) | |
Der Erreger ist häufig im Darm von Kleinkindern (bis zu 80 %) zu finden, aber deutlich seltener im Darm von Erwachsenen (≤ 5 %) zu finden. Die Besiedlung steigt nach einer Krankenhausaufnahme auf ca. 20–40 %.[2] Durch Therapien mit Antibiotika, beispielsweise aus der Klasse der Chinolone, wird das Gleichgewicht der Darmflora unter Umständen gestört und es kommt zu einer Fehlbesiedlung. C. difficile kann aus seiner Nische herauswachsen, sich vermehren und Gifte (Toxine) produzieren. Diese können eine ernsthafte Durchfallerkrankung (Clostridioides difficile-Infektion, Abk. CDI) auslösen.
C. difficile ist die Ursache für 15–20 %[3] aller Antibiotika-assoziierten Durchfallerkrankungen. Auch wenn die Infektion häufig einen leichten Verlauf nimmt, darf sie vor allem in Risikogruppen nicht unterschätzt werden. Unbehandelt können lebensbedrohliche Komplikationen wie eine pseudomembranöse Colitis auftreten, die unter Umständen zu einem toxischen Megakolon führen können.
2008 waren in britischen Kliniken Infektionen mit Clostridioides difficile wesentlich häufiger als in anderen Ländern; in Deutschland hatten CDI 2019 einen Anteil von 10 % an allen dort erfassten nosokomialen Infektionen.[4]
Merkmale
Als Anaerobier ist Clostridioides difficile den frühen Bakterien zuzuordnen, die an die Erdatmosphäre zu Beginn der Entstehung des Lebens angepasst sind, denn diese enthielt praktisch keinen Sauerstoff (siehe Urbakterium). Anaerobier haben auch später keine Möglichkeit entwickelt, sich vor dem aggressiven Sauerstoff der heutigen Atmosphäre zu schützen (siehe Große Sauerstoffkatastrophe, GOE). Ein Leben an der Luft ist demzufolge für C. difficile nicht möglich, da der in der Luft oder in fließendem Wasser vorkommende Sauerstoff auch für Clostridien giftig ist. Um an der Luft zu überleben, verkapselt sich C. difficile zu Sporen, die resistent gegen Sauerstoff und Trockenheit sind.
Die Sporen von Clostridien kommen überall auf der Erde im Boden, in Schmutz oder Staub vor. Unter anaeroben Bedingungen entkapseln sich die Clostridien-Sporen und sind dann in der Lage, sich zu vermehren. 1 bis 4 % der gesunden Bevölkerung trägt C. difficile unbemerkt im Darm und kann die Sporen bei mangelnder Hygiene übertragen. C. difficile ist für den Menschen ein potentiell gefährlicher Krankheitserreger, vor allem dann, wenn beispielsweise bei einer Behandlung im Krankenhaus Antibiotika eingesetzt werden. Ein verwandte Gattung anaerober Bakterien ist Clostridium, u. a. mit Clostridium perfringens, der Erreger des Gasbrandes, Clostridium tetani, der Erreger des Wundstarrkrampfs, und Clostridium botulinum, der Erreger des Botulismus.
Ansteckung, Krankheitsausbruch

Etwa 20 bis 40 % der Krankenhauspatienten sind mit C. difficile besiedelt. Das Bakterium hat die Fähigkeit aerotolerante Sporen zu bilden, die über den Stuhl ausgeschieden werden und so verschiedene Oberflächen kontaminieren können. Die gegen Hitze und viele Desinfektionsmittel unempfindlichen Sporen[5] sind vor allem in Krankenhäusern, Altenheimen und Bädern verbreitet. Die Ansteckung erfolgt fäkal-oral (d. h. vom Stuhl in den Mund) und wird durch mangelnde Hygiene begünstigt. Allerdings wurden mittlerweile auch Sporen in der Luft auf Intensivstationen festgestellt.[6]
Die Keimung der Sporen ist von mehreren Co-Faktoren abhängig. Unter anderem von der Anwesenheit von Glycin und verschiedenen Gallensalzen. Diese binden an den Rezeptor CspC[7] und leiten somit die Wasseraufnahme der Sporen ein, wodurch der Metabolismus hochgefahren wird und die Sporen zu aktiven Zellen reifen.
Zum Ausbruch einer Clostridioides difficile-Infektion (CDI) kommt es, wenn durch eine Therapie mit bestimmten Antibiotika, wie beispielsweise Clindamycin, Cephalosporine und Chinolon-Antibiotika, die natürliche Darmflora zerstört wird. Die Zerstörung des ursprünglichen Gleichgewichts ermöglicht es C. difficile aus seiner Nische herauszuwachsen, sich rasch im Darm zu vermehren und Toxine zu bilden.
Neben einer vorausgegangenen Antibiotika-Therapie gelten als weitere Risikofaktoren: Alter über 65 Jahren, die regelmäßige Einnahme von Immunsuppressiva, nicht-steroidaler Antirheumatika oder Protonenpumpeninhibitoren, den Darm schädigende Chemo- oder Radiotherapie, chronisch-entzündliche Darmerkrankungen, Diabetes mellitus, chronische Nierenerkrankung, sowie ein stark geschwächtes Immunsystem, wie beispielsweise im späteren Verlauf von AIDS.[8]
Säuglinge sind bis zu 100 % mit C. difficile kolonisiert. Die Kolonisation beginnt mit der Geburt oder erfolgt im ersten Lebenshalbjahr. Mögliche Ursachen für ihre Toleranz wären ihr Mangel an C.-difficile-Toxin-A-Rezeptoren an den noch unreifen Enterozyten und eine immunologische Antwort mit Immunglobulin G-Antitoxin. Von den gesunden Zweijährigen sind noch 45 % kolonisiert, von den gesunden Erwachsenen noch 3 % oder weniger.[9]
Symptomatik
Das typische Bild der C. difficile-Infektion ist eine Darmentzündung mit wässrigem Durchfall mit fauligem Geruch. Weitere Symptome sind Fieber und Bauchkrämpfe. Der hohe Wasserverlust, bedingt durch die Diarrhö, führt häufig zur Exsikkose.
Meist handelt es sich bei der Infektion um einen milden bis mittelschweren Krankheitsverlauf. Bei schweren Verläufen können jedoch Komplikationen wie die sogenannte pseudomembranöse Colitis auftreten. Dabei kommt es zu einer Ausschwitzung von Fibrin aus der entzündeten Darmwand, das sich zusammen mit Granulozyten und zerstörten Darmzellen zu einer weißen Schicht auf der Darmwand verbindet. Unbehandelt führt dies zu einer Erschlaffung und grotesken Ausweitung des Darms, dem toxischen Megacolon. In diesem Dickdarmabschnitt kommt es zu einer starken Vermehrung von C. difficile und dadurch zu einer Auflösung der Darmwände. Durch die nachfolgende Ausbreitung der Bakterien im gesamten Körper, der sogenannten Sepsis, besteht akute Lebensgefahr.
Krankheitsmechanismus
Die Entzündung auslösenden Faktoren der C. difficile Infektion sind die vom Pathogen produzierten Toxine A und B[10] (Enterotoxin TcdA; Zytotoxin TcdB). Diese werden auf dem PaLoc-Gen der Zelle codiert und sind die wichtigsten Virulenzfaktoren des Pathogens.
Die Exotoxine werden auf der Oberfläche der Darmzelle erkannt und von dieser aufgenommen. Der veränderte pH-Wert im Endosom induziert eine Strukturänderung, die es den Toxinen ermöglicht eine Pore in der Endosommembran zu formen und so in das Cytosol einzudringen. Dort inaktivieren sie die RHO-GTPase, die für die Ausbildung des Cytoskeletts verantwortlich ist. Es kommt zum Strukturverlust der Zelle und einer daraus resultierenden Lyse. Die Zerstörung der Darmzellen führt zum einen zu einer Störung des Salzhaushaltes, zum anderen wird jedoch auch eine große Menge Flüssigkeit freigesetzt, die als Durchfall ausgeschieden wird.
Gegenüber den früheren Jahren haben seit 2005 Stämme zugenommen, die nur Enterotoxin B produzieren.
Seit 2001 breitet sich, ausgehend von den USA, ein neuer Typ aus. Dieser sogenannte NAP1-Stamm (North American Pulsed field type 1, in Europa auch als R027 bezeichnet) zeichnet sich durch ein binäres Toxin aus und ist durch eine kleine Mutation im Repressorgen tcdC in der Lage, 16× mehr Toxin A und 23× mehr Toxin B zu produzieren. Entsprechend ist seine Virulenz sehr viel höher als die der alten Stämme.
Das binäre Toxin CDT[11] kann von 6–30 % aller Stämme gebildet werden und ist mit einer erhöhten Antibiotikaresistenz assoziiert. Anders als die Toxine A und B, greift CDT direkt die ADP-Ribosyltransferase an und führt so zur Depolimerisation des aus Aktin bestehenden Cytoskeletts. Es kommt zur Zelllyse. Außerdem induziert CDT die Bildung Mikrotubuli basierten auswüchsen an der Zelloberfläche, die die Anlagerung des Pathogens am Darmepithel unterstützen. Diese Fähigkeit trägt enorm zur Hypervirulenz von CDT produzierenden Stämmen bei.
2011 wurde entdeckt, dass Darmzellen Enzyme besitzen, die das Clostridiumtoxin durch Nitrosylierung hemmen. Erst eine massive Ausbreitung der Clostridien überfordert die Kapazität der Enzyme und verursacht somit die Entzündung des Darms.[12]
Nachweis von Clostridioides difficile
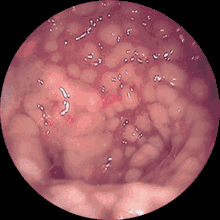
Krankheitsbeweisend ist der Nachweis der produzierten Gifte im Stuhl. Der Nachweis kann durch eine Zellkultur erfolgen, wobei das Exotoxin B das Zellwachstum hemmt. Der Test kann auch kleinste Mengen an Exotoxin nachweisen, ist aber aufwändig. Das Ergebnis liegt erst nach 48 h vor. Häufig wird deshalb ein Antigen- und Toxinnachweis mittels ELISA-Test durchgeführt, der schneller und einfacher, wenn auch manchmal falsch negativ, ist. Die aufwändige Kultivierung des anaeroben Bakteriums ist bei erkrankten Personen nicht sinnvoll, da die Bakterien selber keine Diarrhoe verursachen. Sie dient lediglich der Diagnostik bei gesunden Trägern oder epidemiologischen Untersuchungen. Die pseudomembranöse Colitis kann nur durch eine Darmspiegelung (Koloskopie) nachgewiesen werden.
Vorsorge und Behandlung
Der Einsatz von Antibiotika muss gezielt und kontrolliert erfolgen. Er ist z. B. bei Viruserkrankungen sinnlos.[13]
Zur Bekämpfung einer Clostridioides-difficile-Infektion muss neben dem Ersatz von Flüssigkeit und Salzen mittels Infusion zur Behandlung des Durchfalls der Erreger selbst abgetötet werden. Da manche Antibiotika (besonders Ampicillin, Clindamycin, Cephalosporine) eine Infektion mit C. difficile begünstigen können, kann die Infektion alternativ mit dem Antibiotikum Metronidazol behandelt werden. Wenn der Patient kein Metronidazol verträgt oder es sich um eine schwangere oder stillende Frau handelt, muss auf das Antibiotikum Vancomycin ausgewichen werden. Nicht selten kommt es mehrere Wochen nach Therapie zu einer erneuten Infektion mit C. difficile. Diese muss wieder mit Metronidazol behandelt werden.
Antibiotikaresistenzen sind auf Vancomycin bekannt. Es gibt einige Berichte über Rückfälle bei Therapie mit Metronidazol sowie Berichte zu Resistenzen gegenüber diesem Präparat. Bei einigen Patienten, die zunächst als geheilt galten, ist von mehreren Rückfällen berichtet worden. Eine parallele Behandlung mit Metronidazol und Vancomycin im Akutstadium und eine über einen längeren Zeitraum (5–6 Wochen) ausschleichende Behandlung mit Vancomycin hat sich nachhaltig bewährt. Begleitende Darmspiegelungen zur Überwachung des Heilungserfolgs und zur Absicherung der Befunde sind zu empfehlen. Das toxische Megacolon kann versuchsweise mit denselben Antibiotika behandelt werden. Oft muss jedoch der erweiterte Teil des Darms rasch entfernt werden.
Die Gabe von Bakterien einer gesunden Darmflora als Kapsel kann ebenfalls eine Heilwirkung haben bzw. eine Neubesiedelung mit C. difficile zusätzlich verhindern helfen. Die natürliche Darmflora eines gesunden Spenders kann auch als Fäkal-Transplantation (Syn.: Stuhltransplantation) in den Darm des Erkrankten eingebracht werden.[14][15] Vor allem wird diese auch Fäkaler Mikrobiota-Transfer genannte Behandlung bei wiederkehrenden (rekurrenten) Clostridoides-difficile-Infektionen (rCDI) mit gesicherter Evidenz angewandt.[16] So können sich wieder vermehrt natürliche Darmbakterien ansiedeln, wodurch laut einer im New England Journal of Medicine veröffentlichten Studie das überwuchernde Wachstum von C. difficile vermindert werden kann.[17] Ein Fäkaler Mikrobiota-Transfer gilt (Stand 2020) bei der Behandlung der rekurrenten CDI als Mittel der Wahl.[18]
Im März 2012 erschien eine Doppelblind-Studie in The Lancet Infectious Diseases.[19] Eine Forschungsgruppe an der Universität zu Köln um Studienleiter Oliver A. Cornely belegt darin, dass das Antibiotikum Fidaxomicin im dauerhaften Behandlungserfolg über den bislang üblichen Behandlungsstandard hinausgeht. Dabei ist die Verträglichkeit ebenso gut wie die des herkömmlich verwendeten Antibiotikums Vancomycin.[20] Dificlir (Fidaxomicin) wurde basierend auf zwei ähnlich aufgebauten Phase-III-Nichtunterlegenheitsstudien zugelassen. In diesen wurden 200 mg Fidaxomicin alle 12 Stunden per os mit Vancomycin 125 mg alle 6 Stunden per os für je 10 Tage verglichen.[21]
In einer Studie konnten Mäuse durch Gabe von CamSA, einem Gallensalz-Analog, vollständig von ihren C. difficile-Infektionen befreit werden.[22]
Im Jahr 2019 wurde mit dem Molekül Halicin ein potentiell wirksames Antibiotikum gegen Clostridium difficile gefunden.[23]
Hygienemaßnahmen
Um einer Infektionsverbreitung vorzubeugen, müssen im Umgang mit Erkrankten bestimmte Hygienemaßnahmen konsequent eingehalten werden. Dazu gehört die Basishygiene, wobei dem Händewaschen besondere Bedeutung zukommt: Bei Kontakt mit den sporenbildenden Clostridioides difficile können anhaftende Sporen nur durch Händewaschen reduziert werden,[24] da sie durch die üblichen Hautdesinfektionsmittel auf Alkoholbasis nicht inaktiviert werden. Zur Flächendesinfektion eignen sich laut Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) Desinfektionsmittel, die Glutaraldehyd, Sauerstoffabspalter wie Peroxyessigsäure oder chlorabspaltende Produkte wie Natriumhypochlorit enthalten, da diese Stoffe experimentell eine Wirksamkeit gegen die Sporen des Erregers aufwiesen.[25]
Außerdem empfiehlt die KRINKO bei Verdacht auf oder bei diagnostizierter Clostridioides difficile-Infektion (CDI) neben Barrieremaßnahmen, den symptomatischen Patienten in einem Einzelzimmer mit eigener Nasszelle unterzubringen und diese Isolierung bis mindestens 48 Stunden nach Ende der Durchfallsymptomatik aufrechtzuerhalten.[26]
Wiederauftreten der Infektion
Bei 20–30 % der infizierten Personen treten die Krankheitssymptome einige Wochen bis Monate nach Ende der Behandlung erneut auf. Dies kann zum einen durch eine Reinfektion mit einem anderen pathogenen C. difficile Stamm begründet sein, zum anderen ist jedoch auch ein wiederholtes Ausbrechen (Rezidiv) der ersten Infektion möglich. Ausschlaggebend für eine erneute Erkrankung ist vor allem, dass die ursprüngliche Besiedlung des Darms mit einer gesunden Darmflora nicht schnell genug wieder hergestellt werden kann, wodurch sich C. difficile erneut kolonisiert.
Eine Studie aus dem Jahr 2012 von Paredes-Sabja et al.[27] zur Interaktion zwischen Makrophagen und C. difficile Sporen in vitro ist zu dem Ergebnis gekommen, dass die Sporen einige Mechanismen entwickelt haben, um dem Angriff und der Phagocytose durch das körpereigene Immunsystem standzuhalten. Zwar werden die Bakteriensporen effizient durch die Makrophagen erkannt und auch aufgenommen, jedoch kommt es zu keiner Lyse, solange die Sporen im Ruhezustand verbleiben. Gekeimte Sporen und lebende Bakterien wiederum werden zu einem Großteil durch das Immunsystem zerstört. Einige Bakterien sind jedoch in der Lage den Angriff der Makrophagen zu überleben und neue Kolonien zu bilden.
Die Detektion und Aufnahme der Sporen durch die Fresszellen scheint außerdem durch einen Aktin- abhängigen Mechanismus zu erfolgen und ist aus diesem Grund nicht für alle C. difficile Stämme gleich effizient. Auch gibt es Hinweise darauf, dass die Sporen nicht nur der Aufnahme und Lyse durch die Makrophagen widerstehen können, sondern selbst über einen längeren Zeitraum zytotoxisch auf diese wirken und sie zerstören.
Geschichte
Die Erstbeschreibung erfolgte 1935 durch Hall und O’Toole, die die normale Darmflora bei Säuglingen untersuchten. Sie entdeckten einen häufig vorhandenen Organismus bei über 50 % der gesunden Säuglinge, aber nicht bei Erwachsenen. Da die untersuchten Säuglinge keine Anzeichen einer Erkrankung zeigten, wurde C. difficile (zunächst allerdings „Bacillus difficilus“ genannt) für harmlos gehalten. C. difficile kann sich nur unter Luftabschluss vermehren. Eine Kultivierung in Laboratorien gestaltet sich entsprechend als schwierig. Auf diesen Umstand weist auch der Beiname difficile hin, der aus dem Lateinischen kommend schwierig bedeutet.
1974 berichteten Tedesco et al., dass von 200 Patienten, die das Antibiotikum Clindamycin erhielten, 41 an Durchfall erkrankten und 20 an pseudomembranöser Colitis. 1978 entdeckten Bartlett et al., dass die Antibiotika-assoziierte pseudomembranöse Colitis durch C. difficile hervorgerufen wurde. In den folgenden Jahren wurden die beiden Gifte Exotoxin A und B als eigentliche Krankheitsauslöser erkannt. Klinische Studien zeigten, dass fast jedes Antibiotikum die pseudomembranöse Colitis hervorrufen konnte; Vancomycin wurde zur Standardbehandlung. In den letzten 20 Jahren wurde C. difficile zum häufigsten Erreger einer im Krankenhaus erworbenen Durchfallerkrankung. In den 70er Jahren war der häufigste Auslöser das Antibiotikum Clindamycin, in den 1980er Jahren waren es die Cephalosporine, aktuell scheinen die Fluorchinolone eine wichtige Rolle zu spielen.
Situation Mitte der 2000er Jahre
Die US-amerikanische Seuchenbehörde CDC (Centers for Disease Control and Prevention) in Atlanta kam 2006 zu der Ansicht, dass C. difficile lange Zeit unterschätzt wurde und besonders in letzter Zeit aggressiver geworden ist. Eine Forschergruppe um Michael Warny von der kanadischen University of Sherbrooke vermutete als Ursache eine genetische Veränderung des Bakteriums. Von den Wissenschaftlern wurde im Verlauf einer Epidemie in der Provinz Québec bei 72 von 124 erkrankten Patienten eine Variante isoliert, dem ein Gen mit dem Namen tcdC fehlte. Dieses Gen enthält die Bauanleitung für ein Eiweiß, welches normalerweise die bakterielle Giftproduktion begrenzt. Das genveränderte Bakterium produzierte die Giftstoffe Enterotoxin A und B in 16 beziehungsweise 23 Mal so großen Mengen wie die nicht mutierten Varianten. Diese gesteigerte Giftproduktion der mutierten Bakterienstämme machen die Forscher für die zunehmend heftiger verlaufenden Infektionen und Folgeerkrankungen verantwortlich. Zusätzlich wurde von ihnen bei diesen Bakterien auch noch eine Resistenz gegen die in Nordamerika häufig verordnete Antibiotika-Klasse der Fluorchinolone festgestellt. Außerdem hat eine Forschergruppe um Clifford McDonald von der CDC bei der aggressiven Variante von C. difficile ein weiteres Gift mit der Bezeichnung Cdt festgestellt. Sieben Prozent der von ihnen beobachteten Patienten sind insgesamt an der Clostridium-Infektion gestorben.
Nach Angaben von M. Warny hat sich die Infektionsrate bei C. difficile innerhalb von drei Jahren vor 2005 auch in Großbritannien verdoppelt. In den Niederlanden wurden zwischen 2003 und 2005 zwei Epidemien mit Clostridioides difficile des Subtyps 027 beobachtet.[28] Der Leiter des deutschen Konsiliarlabors für C. difficile in Mainz Christoph von Eichel-Streiber war der Meinung, dass die mutierte Erregervariante auch bereits in Belgien angelangt ist und dass es nur eine Frage der Zeit sei, bis diese auch in Deutschland eintreffe. Bis zum Jahr 2006 wurde dieser neue Typ NAP1 in Europa in England, Frankreich, Belgien, den Niederlanden, Polen, Kroatien und (1 Fall) in Österreich nachgewiesen.
Im April 2007 gelang erstmals der Nachweis des Clostridioides difficile des Subtyps 027 in Trier (Deutschland). Die Infektion mit diesem besonders aggressiven Stamm führt zu einem 5× höheren Todesfallrisiko als bei den bekannten Stämmen. Bei einem Ausbruch der Krankheit im Raum Trier/Bitburg im Oktober 2007 wurden 23 Fälle gezählt. Dieses vermehrte Auftreten wurde von Experten des Robert Koch-Instituts Berlin untersucht. Neun Menschen sind in Trier zwischen April 2007 und Dezember 2007 an dieser gefährlichen Variante von Clostridioides difficile gestorben; bei insgesamt 19 Patienten in Trier konnte das Bakterium nachgewiesen werden.
Im Frühjahr 2008 wurde eine Untersuchung bekannt, wonach in Großbritannien über die Hälfte der Kliniken eine C. difficile-Infektionsrate aufweisen, die mindestens zehnmal so hoch war wie in anderen Ländern. In der Gruppe der über 65-Jährigen war demnach die Todesrate insgesamt zehnmal höher als in anderen Ländern.[29]
Das Bakterium verbreitet sich (Stand Ende 2009) zunehmend auch außerhalb von Kliniken.[30]
Situation in den 2010er Jahren
Eine Studie aus dem Jahr 2013 weist auf die immer größere Verbreitung von C. difficile im Darm von Säuglingen. Bereits wenige Wochen nach der Geburt scheint der Darm schon bei fast 50 % der Säuglinge mit dem Bakterium besiedelt zu sein.[31] Ob die Infektion bei Säuglingen zunimmt, kann aber aufgrund fehlender Vergleichsdaten nicht gesagt werden.
Über die Situation in Österreich berichtete am 23. Januar 2015 der ORF.[32]
Meldepflicht
In Deutschland ist eine Clostridioides-difficile-Infektion mit klinisch schwerem Verlauf eine meldepflichtige Krankheit nach § 6 des Infektionsschutzgesetzes (IfSG). Was eine Infektion mit klinisch schwerem Verlauf ist, wird in den Doppelbuchstaben zu § 6 Absatz 1 Satz 1 Nummer 1a Buchstabe a IfSG definiert. Meldepflichtig ist neben der Erkrankung auch der Tod an einer solchen Infektion.
In Österreich sind schwer verlaufenden Clostridium difficile assoziierten Erkrankungen anzeigepflichtige Krankheiten gemäß § 1 Abs. 1 Nr. 2 Epidemiegesetz 1950. Meldepflichtig sind Erkrankungs- und Todesfälle. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz).
Siehe auch
Literatur
- J. G. Bartlett, T. W. Chang, M. Gurwith, S. L. Gorbach, A. B. Onderdonk: Antibiotic-associated pseudomembranous colitis due to toxin-producing clostridia. In: N Engl J Med. Band 298, 1978, S. 531–534.
- John G. Bartlett, Trish M. Perl: The New Clostridium difficile -- What Does It Mean? In: N Engl J Med., Band 353, 2005, S. 2503–2505.
- R. Fekety, A. B. Shah: Diagnosis and treatment of Clostridium difficile colitis. In: JAMA, 269, 1993, S. 71–75.
- R. H. George, J. M. Symonds, F. Dimock, J. D. Brown, Y. Arabi, N. Shinagawa, M. R. Keighley, J. Alexander-Williams, D. W. Burdon: Identification of Clostridium difficile as a cause of pseudomembranous colitis. In: Br Med J., Band 1, Nr. 6114, 1978, S. 695.
- D. N. Gerding, S. Johnson, L. R. Peterson, M. E. Mulligan, J. Silva Jr.: Clostridium difficile-associated diarrhea and colitis. In: Infection Control and Hospital Epidemiology, Band 16, 1995, S. 459–477.
- I. C. Hall, E. O’Toole: Intestinal flora in newborn infants with a description of a new pathogenic anaerobe Bacillus difficilis. In: Am J Dis Child., Band 49, 1935, S. 390.
- S. Hafiz, C. L. Oakley: Clostridium difficile: isolation and characteristics. In: J Med Microbiol., Band 9, Nr. 2, 1976, S. 129–136.
- Vivian G. Loo, Louise Poirier, Mark A. Miller, Matthew Oughton, Michael D. Libman, Sophie Michaud, Anne-Marie Bourgault, Tuyen Nguyen, Charles Frenette, Mirabelle Kelly, Anne Vibien, Paul Brassard, Susan Fenn, Ken Dewar, Thomas J. Hudson, Ruth Horn, Pierre Rene, Yury Monczak, Andre Dascal: A Predominantly Clonal Multi-Institutional Outbreak of Clostridium difficile-Associated Diarrhea with High Morbidity and Mortality. In: N Engl J Med., Band 353, 2005, S. 2442–2449.
- L. Clifford McDonald, George E. Killgore, Angela Thompson, Robert C. Owens, Jr., Sophia V. Kazakova, Susan P. Sambol, Stuart Johnson, Dale N. Gerding: An Epidemic, Toxin Gene-Variant Strain of Clostridium difficile. In: N Engl J Med., Band 353, 2005, S. 2433–2441.
- Thomas Schneider, Tim Eckmanns, Ralf Ignatius, Klaus Weist, Oliver Liesenfeld: Clostridium-difficile-assoziierte Diarrhö: Ein zunehmendes klinisches Problem durch neue hochvirulente Erreger. In: Deutsches Ärzteblatt, 104, Ausgabe 22, 1. Juni 2007, S. A-1588, MEDIZIN: Übersichtsarbeit
- L. D. Smith, E. O. King: Occurrence of Clostridium difficile in infections of man. In: J Bacteriol., Band 84, 1962, S. 65–67.
- F. J. Tedesco, R. W. Barton, D. H. Alpers: Clindamycin-associated colitis: a prospective study. In: Ann Intern Med., Band 81, 1974, S. 429–433.
- C. Wenisch, B. Parschalk, M. Hasenhundle u. a.: Comparison of vancomycin, teicoplanin, metronidazole, and fusidic acid for the treatment of Clostridium difficile-associated diarrhea. In: Clin Infect Dis., Band 22, 1996, S. 813–818.
- T. D. Wilkins, D. M. Lyerly: Clostridium difficile testing: after 20 Years, still challenging. In: J Clin Microbiol. Band 41, 2003, S. 531–534.
- E. Mylonakis, E. T. Ryan, S. B. Calderwood: Clostridium difficile-associated diarrhea: a review. In: Arch Intern Med., Band 161, 2000, S. 525–533.
- Intensivmedizin C difficile auch in der Luft.htm Clostridium difficile auch in der Luft. In: Deutsches Ärzteblatt, 26. Mai 2010
Weblinks
- Leitlinie Hygienemaßnahmen bei Vorkommen von Clostridium difficile der "Krankenhaus- & Praxishygiene"-Arbeitsgruppe der AWMF. In: AWMF online (Stand August 2006)
- Clostridioides difficile – Informationen des Robert Koch-Instituts
- Forschung aktuell. Deutschlandfunk, 4. November 2009
- Epidemiologie und Prävention von Clostridium difficile (Schweiz)
- Overview of Clostridium Difficile Infections (USA). Centers for Disease Control and Prevention
Einzelnachweise
- Robert Koch-Institut, Berlin: RKI-Ratgeber Clostridioides, abgefragt am 25. Juli 2020.
- Clostridioides (früher Clostridium) difficile. In: RKI-Ratgeber. 2. Februar 2018, abgerufen am 18. September 2021.
- RKI – RKI-Ratgeber – Clostridioides (früher Clostridium) difficile. Abgerufen am 4. Dezember 2020.
- Hygienemaßnahmen bei Clostridioides difficile-Infektion (CDI). Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut, Bundesgesundheitsbl 2019 · 62:906–923. (PDF) Abgerufen am 8. November 2021.
- KRINKO-Empfehlung Hygienemaßnahmen bei Clostridioides difficile-Infektion (CDI). (PDF) 2019, S. 907; abgerufen am 26. September 2019.
- Intensivmedizin: C. difficile auch in der Luft. aerzteblatt.de, 26. Mai 2010.
- Michael B. Francis, Charlotte A. Allen, Ritu Shrestha, Joseph A. Sorg: Bile Acid Recognition by the Clostridium difficile Germinant Receptor, CspC, Is Important for Establishing Infection. In: PLOS Pathogens. Band 9, Nr. 5, 5. September 2013, ISSN 1553-7374, S. e1003356, doi:10.1371/journal.ppat.1003356, PMID 23675301, PMC 3649964 (freier Volltext) – (plos.org [abgerufen am 4. Dezember 2020]).
- KRINKO-Empfehlung Hygienemaßnahmen bei Clostridioides difficile-Infektion (CDI). (PDF) 2019, S. 909; abgerufen am 26. September 2019.
- Franz Allerberger u. a.: Clostridium difficile-Infektion. In: Österreichische Ärztezeitung. Nr. 5, 10. März 2014 (aerztezeitung.at [PDF]).
- Thomas Jank, Torsten Giesemann, Klaus Aktories: Rho-glucosylating Clostridium difficile toxins A and B: new insights into structure and function. In: Glycobiology. Band 17, Nr. 4, 1. April 2007, ISSN 1460-2423, S. 15R–22R, doi:10.1093/glycob/cwm004 (oup.com [abgerufen am 4. Dezember 2020]).
- Klaus Aktories, Panagiotis Papatheodorou, Carsten Schwan: Binary Clostridium difficile toxin (CDT) – A virulence factor disturbing the cytoskeleton. In: Anaerobe (= ClostPath 2017: 10th International Conference on the Molecular Biology and Pathogenesis of the Clostridia). Band 53, 1. Oktober 2018, ISSN 1075-9964, S. 21–29, doi:10.1016/j.anaerobe.2018.03.001 (sciencedirect.com [abgerufen am 4. Dezember 2020]).
- Tor C Savidge, Petri Urvil, Numan Oezguen, Kausar Ali, Aproteem Choudhury: Host S-nitrosylation inhibits clostridial small molecule–activated glucosylating toxins. In: Nature Medicine. 2011. doi:10.1038/nm.2405.
- dradio.de
- Fäkal-Transplantation heilt C. difficile-Infektion. auf: aerzteblatt.de, 17. Januar 2013.
- Don’t poo-poo technique: Fecal transplant can cure superbug, doctors say. In: CBC. 13. November 2007.
- Andreas Stallmach u. a.: Fäkaler Mikrobiota-Transfer. Gesicherte Indikationen, Spenderscreening und Applikationsformen. In: Deutsches Ärzteblatt. Band 117, Heft 3, 17. Januar 2020, S. 31–38.
- E. van Nood, A. Vrieze, M. Nieuwdorp, S. Fuentes, E. G. Zoetendal, W. M. de Vos, C. E. Visser, E. J. Kuijper, J. F. W. M. Bartelsman, J. P. G. Tijssen, P. Speelman, M. G. W. Dijkgraaf, J. J. Keller: Duodenal. Infusion of Donor Feces for Recurrent Clostridium difficile. In: NEJM. doi:10.1056/NEJMoa1205037.
- Andreas Stallmach u. a.: Fäkaler Mikrobiota-Transfer. Gesicherte Indikationen, Spenderscreening und Applikationsformen. 2020.
- Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada, and the USA: a double-blind, non-inferiority, randomised controlled trial. thelancet.com, Abstract
- Erfolg in der Behandlung der potentiell tödlichen Clostridium difficile-Infektion. „Seit Mai 2011 ist Fidaxomicin in den USA und seit Dezember 2011 in Europa zur Behandlung von Erwachsenen mit CDI zugelassen.“
- Neue Arzneimittel (PDF; 198 kB) Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), Stand: 15. März 2013.
- A. Howerton, M. Patra, E. Abel-Santos: A new strategy for the prevention of Clostridium difficile infection. In: The Journal of infectious diseases. Band 207, Nummer 10, Mai 2013, S. 1498–1504, ISSN 1537-6613. doi:10.1093/infdis/jit068. PMID 23420906.
- Julia Merlot, DER SPIEGEL: Kampf gegen Resistenzen: Künstliche Intelligenz entdeckt vielversprechendes Antibiotikum – DER SPIEGEL – Wissenschaft. Abgerufen am 22. Februar 2020.
- KRINKO-Empfehlung Hygienemaßnahmen bei Clostridioides difficile-Infektion (CDI). (PDF) 2019, S. 912; abgerufen am 26. September 2019.
- Hygienemaßnahmen bei Clostridioides difficile-Infektion (CDI). Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut, Bundesgesundheitsbl 2019 · 62:906–923. (PDF) S. 913, abgerufen am 8. November 2021.
- KRINKO-Empfehlung Hygienemaßnahmen bei Clostridioides difficile-Infektion (CDI). (PDF) 2019, S. 912 und 916; abgerufen am 26. September 2019.
- Daniel Paredes-Sabja, Glenda Cofre-Araneda, Christian Brito-Silva, Marjorie Pizarro-Guajardo, Mahfuzur R. Sarker: Clostridium difficile Spore-Macrophage Interactions: Spore Survival. In: PLOS ONE. Band 7, Nr. 8, 27. August 2012, ISSN 1932-6203, S. e43635, doi:10.1371/journal.pone.0043635, PMID 22952726, PMC 3428350 (freier Volltext) – (plos.org [abgerufen am 4. Dezember 2020]).
- The Lancet – Pressemeldung – Studie bietet Einbli... In: www.wissenschaft-online.de. Abgerufen am 25. November 2016.
- UK c.diff deaths ‘rising sharply’. BBC, 26. April 2008.
- Resistente Erreger verlassen die Klinik. Deutschlandfunk, 2. November 2009.
- I. Adlerberth, H. Huang, E. Lindberg, N. Aberg, B. Hesselmar, R. Saalman, C. E. Nord, A. E. Wold, A. Weintraub: Toxin-producing Clostridium difficile strains as long-term gut colonizers of healthy infants. In: Journal of Clinical Microbiology. doi:10.1128/JCM.01701-13.
- Unterschätzt: Krankenhauskeim in Österreich. science.ORF.at, .23. Januar 2015.