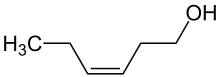
cis-3-Hexenol
cis-3-Hexenol oder auch Blätteralkohol ist eine natürlich vorkommende chemische Verbindung aus der Gruppe der ungesättigten Alkohole. Die ölige Flüssigkeit, die zumindest in Spuren in den grünen Teilen von fast allen Pflanzen vorkommt,[8] riecht stark nach frisch geschnittenem Gras und zählt zu den grünen Blattduftstoffen.[9]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | cis-3-Hexenol | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C6H12O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit angenehmem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 100,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,847 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
156,5 °C[3] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4380 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
cis-3-Hexenol kommt in den Blüten, Blättern und Früchten verschiedener Pflanzen, wie Tulpen, Pelargonien (Pelargonium graveolens),[10] Gartenhyazinthe (Hyacinthus orientalis),[10] Jasmin (Jasminum officinale),[10] Äpfeln, Bananen, Weintrauben, Mandarinen (Citrus reticulata),[10] Wilder Bergamotte (Monarda fistulosa),[10] Citrus aurantium,[10] Ananas,[11] Tomaten (Lycopersicon esculentum),[12] Sellerie (Apium graveolens),[10] Teepflanze, Kampherbaum (Cinnamomum camphora),[10] Bay (Pimenta racemosa),[10] Lorbeer (Laurus nobilis),[10] Basilikum (Ocimum basilicum),[10] Piment (Pimenta dioica)[10] und in Wermutkraut (Artemisia absinthium)[13] vor. Die ätherischen Öle der Gewöhnlichen Robinie und der Maulbeere enthalten bis zu 50 % Blätteralkohol.[8] Auch der Ester mit Essigsäure, Essigsäurehex-3-enylester, kommt in vielen Pflanzen vor.
.jpg.webp) Wein
Wein Basilikum
Basilikum Bergamotte
Bergamotte.JPG.webp) Gartenhyazinthe
Gartenhyazinthe
Gewinnung und Synthese
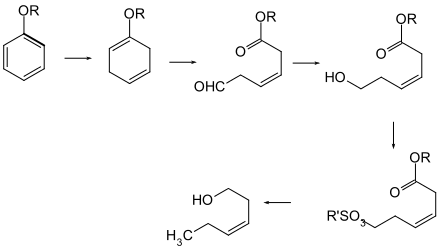
cis-3-Hexenol wird durch Extraktion aus Pflanzen und Früchten gewonnen oder synthetisch hergestellt.
Die Synthese erfolgt aus Alkoxyphenolen durch Hydrierung, Ringöffnung durch Ozonolyse und anschließende Reduktion zum Alkohol.[14]
Eigenschaften
cis-3-Hexenol ist eine farblose, ölige Flüssigkeit, die sich wenig in Wasser[2], dagegen gut in Ethanol löst.[3] Der Duft wird schon in einer Konzentration von 70 ppb wahrgenommen; ein deutlicher Geruch nach grünen Früchten tritt ab etwa 30 ppm auf.[11] Die orale Giftigkeit ist gering: im Tierversuch mit Mäusen und Ratten wurden LD50-Werte von 4,7 g/kg (Ratte[5]) und 7 g/kg (Maus[7]) ermittelt.[6]
Verwendung
cis-3-Hexenol wird als Duftstoff in Tee, Parfüm (z. B. von Veilchenduft)[15] und Lebensmitteln[11] sowie als Ausgangsmaterial für die Synthese von 2-trans-6-cis-Nonadien-1-ol, 2-trans-6-cis-Nonadien-1-al und Essigsäurehex-3-enylester verwendet.
Die Substanz wird bei vielen Pflanzen – neben dem Essigsäurehex-3-enylester – nach einer Verletzung des Gewebes zur Abtötung von Pilzen (Fungizid) und Bakterien (Bakterizid) sowie als Abwehrstoff gegen pflanzenfressende Tiere, meist Insekten, ausgeschüttet.[9]
Einzelnachweise
- Eintrag zu 3-HEXENOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu cis-Hex-3-en-1-ol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-284.
- Datenblatt Cis-3-Hexenol (PDF) bei Merck, abgerufen am 18. Januar 2011.
- Food and Cosmetics Toxicology. Vol. 7, 1969, S. 451.
- Eintrag zu 3-Hexenol in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Food and Cosmetics Toxicology. Vol. 12, 1974, S. 909.
- Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Band 15, 2012, S. 73–198, doi:10.1002/14356007.a11_141.
- John D’Auria: Die Welt der Naturstoffe: Untersuchungen von Esterverbindungen und Acyltransferasen am Modellsystem Arabidopsis thaliana. (PDF; 9,9 MB) In: Max-Planck-Institut für chemische Ökologie, Jena: Tätigkeitsbericht 2008.
- CIS-3-HEXENOL (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 26. Juli 2021.
- George A. Burdock: Fenaroli's handbook of flavor ingredients. 5. Auflage, CRC Press, 2005, ISBN 0-8493-3034-3, S. 797–798.
- CIS-3-HEXENOL-1 (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 26. Juli 2021.
- Otto Vostrowsky, Thorolf Brosche, Helmut Ihm, Robert Zintl, Karl Knobloch: Über die Komponenten des ätherischen Öls aus Artemisia absinthium L.. In: Zeitschrift für Naturforschung C. 36, 1981, S. 369–377 (PDF, freier Volltext).
- U.S. Patent 3962354.
- chemistryworld.de.

