Brompropansäuren
Brompropansäuren sind aliphatische Carbonsäuren mit drei Kohlenstoffatomen, bei denen eines der an einem Kohlenstoffatom gebundenen Wasserstoffatome durch ein Bromatom ersetzt ist. Sie sind damit Derivate der Propionsäure.
| Brompropionsäuren | |||||
| Name | 2-Brompropionsäure | 3-Brompropionsäure | |||
| Andere Namen | 2-Brompropansäure α-Brompropansäure | 3-Brompropansäure β-Brompropansäure | |||
| Strukturformel | 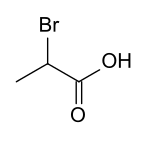 | 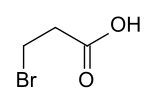 | |||
| CAS-Nummer | 10009-70-8 [(R)-(+)-Enantiomer] 32644-15-8 [(S)-(−)-Enantiomer] 598-72-1 (Racemat) | 590-92-1 | |||
| PubChem | 11729 | 11553 | |||
| Summenformel | C3H5O2Br | ||||
| Molare Masse | 152,98 g·mol−1 | ||||
| Aggregatzustand | flüssig (Enantiomere) fest bei 20 °C (Racemat) | fest | |||
| Schmelzpunkt | −0,5 °C (Enantiomere)[1] 25–26 °C (Racemat)[1][2] |
61–63 °C[3] | |||
| Siedepunkt | 203 °C[2] | 140–142 °C (45 mm Hg)[4] | |||
| Flammpunkt | 100 °C[5] | 65 °C[2] | |||
| pKs-Wert | 2,97 (18 °C)[6] | ||||
| Dichte | 1,7 g/cm3 (25 °C)[7] | 1,48 g/cm3[3] | |||
| Dampfdruck | 0,133 hPa (25 °C)[7] | ||||
| Löslichkeit | löslich in Wasser[2][3] | ||||
| Brechungsindex | 1,475 (20 °C, 589 nm)[7] | ||||
| GHS- Kennzeichnung |
|
| |||
| H- und P-Sätze | 314‐302 | 301‐314 | |||
| keine EUH-Sätze | keine EUH-Sätze | ||||
| 260‐301+330+331‐303+361+353 305+351+338‐405‐501 |
260‐301+310‐303+361+353 305+351+338‐405‐501 | ||||
| LD50 | 323 mg·kg−1 (oral, Ratte)[7] | 1451 mg·kg−1 (oral, Ratte)[4] | |||
Darstellung und Gewinnung
2-Brompropansäure
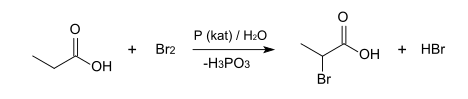
2-Brompropionsäure kann durch die Hell-Volhard-Zelinsky-Reaktion aus Propionsäure, Brom und rotem Phosphor dargestellt werden. Dabei wird das Racemat erhalten.
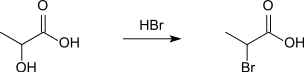
2-Brompropansäure entsteht auch durch Erhitzen von Milchsäure und gesättigter Bromwasserstoffsäure im geschlossenen Rohr.[8]
3-Brompropansäure
3-Brompropansäure kann durch Addition von Bromwasserstoff an Acrylsäure gewonnen werden.[9]
Eine weitere Synthese geht vom 2-Chlorethanol aus, das zunächst mit Natriumcyanid zu 2-Cyanoethanol umgesetzt wird. Dieses reagiert mit Bromwasserstoff und anschließender Hydrolyse zur 3-Brompropansäure.[10][11]
Auch bei der Oxidation von 3-Brompropanal mit Salpetersäure entsteht 3-Brompropansäure.[12]
Eigenschaften
Beide Brompropionsäuren sind bei Raumtemperatur feste, farblose, stechend riechende, wasserlösliche Substanzen. Die Säurestärke liegt wegen des −I-Effekts der Halogenatome über der der Stammverbindung Propionsäure. 2-Brompropionsäure ist optisch aktiv, da sie am zweiten C-Atom ein Chiralitätszentrum besitzt. Die Enantiomeren schmelzen bei −0,5 °C, wobei auch eine metastabile polymorphe Form mit einem Schmelzpunkt bei −10 °C beobachtet wurde.[1] Das Racemat liegt folgend aus dem hohen Schmelzpunkt bei 25,7 °C[1] als racemische Verbindung vor. Auch hier wurde eine metastabile polymorphe Form mit einem Schmelzpunkt bei −3,9 °C beobachtet.[1] Die racemische Mischung der beiden Enantiomeren sollte einen Schmelzpunkt um −20 °C besitzen.[1]
Reaktionen
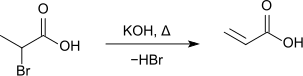
2-Brompropansäure kann durch Erhitzen mit Kaliumhydroxid dehydrohalogeniert werden, es entsteht Acrylsäure.[13]
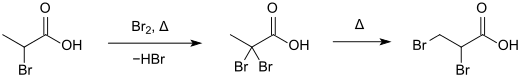
2-Brompropansäure kann durch Erhitzen mit elementarem Brom im geschlossenen Rohr in 2,2-Dibrompropansäure umgewandelt werden.[14], die sich beim weiteren Erhitzen in die 2,3-Dibrompropansäure umlagert.[12]
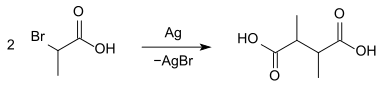
2-Brompropansäure kondensiert beim Erhitzen mit Silberpulver 2,3-Dimethylbernsteinsäure.[12]
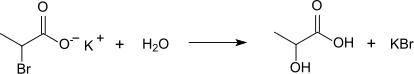
Das in Wasser gelöste Kaliumsalz der 2-Brompropansäure zerfällt beim längeren Stehen in der Kälte in Kaliumbromid und Milchsäure.[12]
Im basischen Milieu hydrolysieren die Brompropansäuren zu den entsprechenden Hydroxypropansäuren.[9]
Verwendung
Beide isomeren Brompropionsäuren werden als Ausgangsstoffe für die Herstellung von Pharmazeutika und Pestiziden verwendet.[2] Außerdem dienen sie als Alkylierungsmittel für Mercaptane und andere schwefelhaltige Verbindungen.[2] Aus 2-Brompropionsäure kann durch Fischer-Synthese Alanin hergestellt werden.
Toxikologie
3-Brompropionsäure zeigte im Tierversuch tumorerzeugende Wirkung.[4]
Einzelnachweise
- L. Ramberg: Zur Kenntnis der α–Brompropionsäuren, in: Justus Liebigs Ann. Chem., 1909, 370, S. 234–239; doi:10.1002/jlac.19093700112.
- Datenblatt 2-Brompropionsäure bei www.chemicalland21.com
- Datenblatt 3-Brompropionsäure bei www.chemicalland21.com.
- Datenblatt 3-Brompropionsäure bei AlfaAesar, abgerufen am 15. August 2010 (PDF) (JavaScript erforderlich).
- Datenblatt 2-Brompropionsäure bei AlfaAesar, abgerufen am 15. August 2010 (PDF) (JavaScript erforderlich).
- Eintrag zu 2-Bromopropionic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Datenblatt 2-Brompropionsäure (PDF) bei Merck, abgerufen am 15. August 2010.
- A. Kekulé: "Über organische Säuren: Einwirkung von Bromwasserstoff auf mehratomige Säuren" in Justus Liebigs Annalen der Chemie, 1864, 130 (1), S. 11–31. doi:10.1002/jlac.18641300103
- E. Kowski: "Ueber gebromte Propionsäuren" in Justus Liebigs Annalen der Chemie, 1905, 342 (1), S. 124–138. doi:10.1002/jlac.19053420109
- E. C. Kendall, B. McKenzie: β-Bromopropionic Acid In: Organic Syntheses. 3, 1923, S. 25, doi:10.15227/orgsyn.003.0025; Coll. Vol. 1, 1941, S. 131 (PDF).
- E. C. Kendall, B. McKenzie: Ethylene Cyanohydrin In: Organic Syntheses. 3, 1923, S. 57, doi:10.15227/orgsyn.003.0057; Coll. Vol. 1, 1941, S. 256 (PDF).
- F. Beilstein: Handbuch der organischen Chemie, 3. Auflage, 1. Band. Verlag Leopold Voss, 1893. S. 480. Volltext
- R. K. Bansal: A Textbook Of Organic Chemistry. New Age International, 2003, ISBN 81-224-1459-1, S. 541 (eingeschränkte Vorschau in der Google-Buchsuche).
- O. Philippi, B. Tollens: "Untersuchungen über die Allylgruppe. XIII. Ueber die α-Bibrompropionsäure" in Justus Liebigs Annalen der Chemie, 1874, 171 (2), S. 313–333. doi:10.1002/jlac.18741710219