Aktivierung (Chemie)
Als Aktivierung bezeichnet man in der Chemie die Überführung eines Reaktanten in einen Zustand oder eine chemische Verbindung, die eine bestimmte Reaktion oder einen Reaktionstyp aufgrund einer erhöhten Reaktivität mit höherer Geschwindigkeit oder Ausbeute ablaufen lässt. Die Möglichkeiten hierfür sind vielfältig und häufig Gegenstand intensiver Forschungen, vor allem bei der Entwicklung von Synthesen, die im großtechnischen Maßstab umgesetzt werden sollen.
Grundlagen
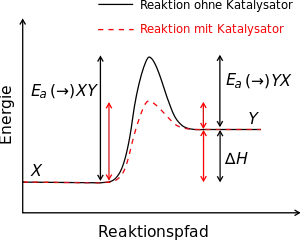
Damit eine chemische Reaktion abläuft, muss zunächst eine gewisse Menge Energie zugeführt werden, die sogenannte Aktivierungsenergie. Bei spontan ablaufenden Reaktionen reicht als Aktivierungsenergie die Umgebungstemperatur aus, bei anderen Reaktionen kann durch eine Erhöhung der Temperatur die Aktivierungsenergiebarriere überwunden werden. Mit einer Steigerung der Temperatur steigt aber nicht nur die Reaktionsgeschwindigkeit, bei vielen chemischen Prozessen laufen dann auch Nebenreaktionen ab, die die Ausbeute des gewünschten Produkts verringern. Daher wird oft anderen Möglichkeiten gegenüber einer bloßen Temperaturerhöhung der Vorzug gegeben.
Eine Alternative zur Zuführung thermischer Energie ist die Bestrahlung mit Licht (photochemische Aktivierung).[1]
Es können auch Katalysatoren eingesetzt werden, die Oberfläche eines Reaktionspartners kann verändert werden oder die Reaktion kann über eine leicht zugängliche Zwischenstufe, die sich wiederum leicht zum Zielmolekül umsetzen lässt, geführt werden.
Verwendung von Katalysatoren
Im Zusammenhang mit der Verwendung von Katalysatoren wird ebenfalls oft von einer Aktivierung einer Substanz gesprochen, wenn bei der Chemisorption an der Katalysatoroberfläche die Bindungsverhältnisse oder die elektronischen Eigenschaften eines Moleküls sich so verändern, dass die Aktivierungsenergie für eine Reaktion herabgesetzt wird. Ein Beispiel hierfür ist die Ammoniak-Synthese nach dem Haber-Bosch-Verfahren, bei dem der extrem reaktionsträge Stickstoff nur dann in vernünftigen Ausbeuten mit Wasserstoff zu Ammoniak umgesetzt werden kann, wenn die Reaktion an der Oberfläche eines Eisenoxid-Mischkatalysators abläuft.
Aktivierung durch Oberflächenmodifikation
Durch die Vergrößerung der Oberfläche einer Substanz kann deren Reaktivität drastisch erhöht werden. Ein prominentes Beispiel hierfür ist Raney-Nickel, das aufgrund seiner porösen Struktur in einer Vielzahl von Laborsynthesen und industriellen Prozessen eingesetzt wird, hauptsächlich in der Hydrierung von ungesättigten Verbindungen.
Die feine Verteilung eines Stoffes in kleine Partikel kann ebenfalls zu dessen Aktivierung beitragen. So ist feine Stahlwolle gut brennbar, ein Block von solidem Stahl jedoch nicht. Feine Stäube, beispielsweise von Mehl oder Holz, können sogar explodieren (siehe Staubexplosion).
Chemische Aktivierung
Chemisch können Substrate für bestimmte Reaktionen aktiviert werden, indem sie in eine dafür geeignete Zwischenverbindung überführt werden. So hängt es bei Substitutionsreaktionen von der Güte der Abgangsgruppe ab, ob die Reaktion abläuft oder nicht. Wird eine Hydroxy-Gruppe, die eine schlechte Abgangsgruppe darstellt, dagegen zunächst in einen Ester, eine gute Abgangsgruppe, überführt, so lassen sich leicht Substitutionen beispielsweise mit Halogeniden realisieren.
Ein häufig beobachteter Schritt innerhalb eines Reaktionsmechanismus ist die Protonierung einer funktionellen Gruppe, die die Eigenschaften dieser Gruppe oder des Moleküls elektronisch beeinflusst und so Reaktionen häufig erst ermöglicht.
Beim Aufbau von Peptiden, wie nach der Merrifield-Synthese, überführt man die freien Säuregruppen der Aminosäuren mit Reagenzien wie Dicyclohexylcarbodiimid (DCC) zunächst in sogenannte Aktivester, die sich dann leicht mit der freien Aminofunktion der folgenden Aminosäure kuppeln lassen.
Bei der elektrophilen aromatischen Substitution spricht man von aktivierenden Substituenten, wenn bereits am Ringsystem vorhandene Gruppen die Elektronendichte im Aromaten erhöhen (+M-Effekt) und damit die Reaktion eines Elektrophils erleichtern.
Biochemische Aktivierung
In der Biochemie bezeichnet man mit Aktivierung häufig den ersten Schritt in einer biochemischen Reaktionsabfolge, der an einem vergleichsweise inaktiven Substrat eine Modifikation vornimmt, durch die eine Reaktionskaskade in Gang gesetzt wird. Beispielsweise stellt die Acetylierung durch das Coenzym A als Acetylgruppenüberträger einen zentralen Reaktionsschritt im Fett-, Kohlenhydrat- und Proteinstoffwechsel dar. Acetyl-Coenzym A bezeichnet man daher auch als aktivierte Essigsäure. Ein weiteres Beispiel ist eine Phosphorsäureesterbindung (und auch deren Variante der Phosphodiesterbindung), die durch Phosphorylierung erzeugt wird, beispielsweise bei Adenosintriphosphat.
Siehe auch
Literatur
- K. Hertwig, L. Martens: Chemische Verfahrenstechnik: Berechnung, Auslegung und Betrieb chemischer Reaktoren, Oldenbourg Wissenschaftsverlag München 2007, ISBN 978-3-486-57798-3, Kapitel 4.4: Chemische Aktivierungsprinzipien in industriellen Reaktoren.
Einzelnachweise
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 95.