5-Aminotetrazol
5-Aminotetrazol ist ein von Tetrazol abgeleiteter fünfgliedriger heterocyclischer Aromat, bei dem das H-Atom am einzigen Kohlenstoffatom im Ring durch eine Aminogruppe ersetzt ist. Die Substanz ist ein Ampholyt, d. h. sie besitzt saure und basische Eigenschaften und ist Reaktionen an der aziden NH-Gruppe in 1-Stellung und an der 5-Aminogruppe zugänglich. Wegen seines extrem hohen Stickstoffanteils von 82,3 Gewichtsprozent eignet sich 5-Aminotetrazol als Gasgenerator in pyrotechnischen Anwendungen, wie z. B. in Airbags und als Ausgangsverbindung für Explosivstoffe.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
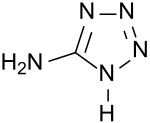 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 5-Aminotetrazol | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel |
| ||||||||||||
| Kurzbeschreibung |
weißes Kristallpulver[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 85,07 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt |
201–205 °C[2] | ||||||||||||
| Löslichkeit |
löslich in Wasser (12 g·l−1 bei 18 °C)[1] und in Ethanol, unlöslich in Diethylether | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Vorkommen und Darstellung
Die Darstellung von 5-Aminotetrazol (damals als Amidotetrazotsäure bezeichnet) durch Einwirkung von salpetriger Säure HNO2 auf Aminoguanidin wurde 1892 von Johannes Thiele beschrieben[3] und die Verbindung als Ausgangsstoff für Azofarbstoffe patentiert.[4]
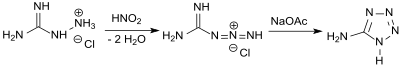
Bereits damals wurde gefunden, dass bei der Synthese in wässrigen Medien 5-Aminotetrazol als Monohydrat „in Blättern oder Prismen“ kristallisiert, das beim Erhitzen in die wasserfreie Substanz übergeht. Eine Strukturformel konnte für die so genannte „Amidotetrazotsäure“ noch nicht angegeben werden. Die korrekte Strukturformel wurde von Arthur Hantzsch 1901 publiziert,[5] der 5-Aminotetrazol bei der Reaktion von Cyanamid und Stickstoffwasserstoffsäure erhielt.
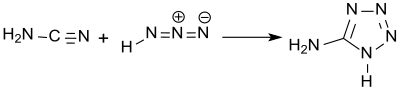
Statt Cyanamid kann auch sein Dimer Dicyandiamid eingesetzt werden.[6] Den Umgang mit der äußerst problematischen Stickstoffwasserstoffsäure vermeidet der Einsatz von Natriumazid und konzentrierter Salzsäure, wobei 5-Aminotetrazol als Hydrat in 73 %iger Ausbeute entsteht.[7]
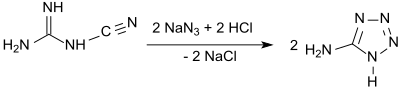
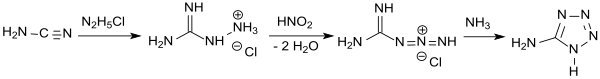
In einer wesentlich effizienteren und besser kontrollierbaren Eintopfreaktion[8] wird Cyanamid mit Hydraziniumchlorid zu Aminoguanidiniumchlorid umgesetzt, das ähnlich wie in der Vorschrift von J. Thiele angegeben mit salpetriger Säure im Sauren zum Guanylazid-hydrochlorid diazotiert wird. Anschließend wird mit Ammoniak oder Natriumhydroxid[9] schwach sauer gestellt und erhitzt, wobei Cyclisierung zum 5-Aminotetrazol erfolgt, das nach Trocknung als wasserfreies Produkt in 74 %iger Ausbeute anfällt.
Die Aminierung von 1H-Tetrazoliumsalzen mit Hydroxylamin-O-sulfonsäure liefert kein 5-Aminotetrazol, sondern ein 2:1-Gemisch von 1- und 2-Aminotetrazol in einer Gesamtausbeute von 38 %.[10][11]
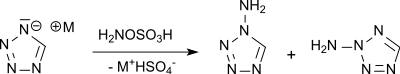
Im Gegensatz zum C-Aminotetrazol 5-AT neigen N-Aminotetrazole, insbesondere das 2-Aminotetrazol, beim raschen Erhitzen zu heftigen Explosionen.
Eigenschaften
Wasserfreies 5-Aminotetrazol ist ein weißer kristalliner Feststoff, der sich in Wasser und Ethanol löst. Die Verbindung ist wenig toxisch, temperaturstabil und nicht schlagempfindlich. Als Ampholyt reagiert 5-AT als schwache Säure und gegenüber starken Säuren, wie z. B. wässrigen Halogenwasserstofflösungen, Salpetersäure, Perchlorsäure usw. als schwache Base und bildet die entsprechenden 5-Aminotetrazoliumsalze.[12]
Anwendungen
5-Aminotetrazol bildet mit Alkalihydroxiden und besonders mit basischen Aminoverbindungen, wie z. B. Hydrazin, Guanidin oder Aminoguanidin thermisch und hydrolytisch stabile Salze mit extrem hohen Stickstoffgehalten. Die Alkalisalze eignen sich als flammenfärbende Zusätze in Feuerwerkskörpern, die Ammoniumsalze als ionische Flüssigkeiten und als Treibsatzadditive.[13]
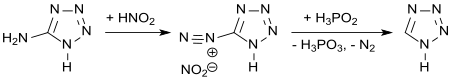
Aus 5-Aminotetrazol ist die Stammverbindung Tetrazol durch Dediazonierung, also Diazotierung und anschließende Reduktion des Diazoniumsalzes mit hypophosphoriger Säure, in 77 %iger Ausbeute zugänglich.[14]
Alkylierung von 5-Aminotetrazol, z. B. mit Dimethylsulfat oder Methyliodid führt zu einem Gemisch von überwiegend 1-Methyl-5-aminotetrazol neben 2-Methyl-5-aminotetrazol.[15]
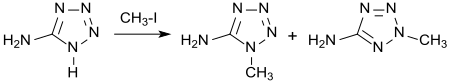
Ist die 1-Stellung durch einen Substituenten blockiert, dann wird die 5-ständige Aminogruppe alkyliert.[16]
Die Acylierung von 5-Aminotetrazol mit Carbonsäureanhydriden oder Carbonsäurechloriden erzeugt die entsprechenden 5-Acylamidotetrazole, die sich als Schaummittel für Polymerschäume und zur Gaserzeugung in Airbags eignen.[17]
Mit Monochloressigsäure reagiert 5-AT zu 5-Aminotetrazol-1-essigsäure in 53 %iger Ausbeute,[18] die mit Salpetersäure zur 5-Nitroiminoverbindung nitriert werden kann. Die mit stickstoffreichen Kationen gebildeten Salze der 5-Nitroiminotetrazol-1-essigsäure werden von den Autoren als umweltfreundliche Explosivstoffe klassifiziert.[19]

Einen effizienten Zugang zu Isocyaniden in hohen Ausbeuten eröffnet die Oxidation von 5-Aryl- bzw. 5-Alkylaminotetrazolen.[20]
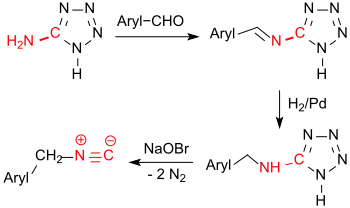
Benzylisocyanid wird auf diesem Wege in einer Gesamtausbeute von 67 % erhalten.
Mit 1-Tetralon und einem aromatischen Aldehyd reagiert 5-Aminotetrazol in einer Mehrkomponentenreaktion unter Mikrowellenbestrahlung zu einem viergliedrigen heterocyclischen Ringsystem.[21]
Acylierung von 5-AT mit Methacryloylchlorid führt zu dem wasserlöslichen Monomer 5-(Methacrylamido)tetrazol, das mit Acrylamid copolymerisiert und mit N,N′-Methylenbisacrylamid zu vernetzten Gelen mit Superabsorbereigenschaften polymerisiert werden kann.[22]
tetrazol_Synthese_aus_5-Aminotetrazol.svg.png.webp)
5-Aminotetrazol ist Ausgangsverbindung für eine Reihe von so genannten (hoch)energetischen Materialien (engl. high energy density materials, HEDMs), d. h. Sprengstoffen und Treibladungen.[23]
Die wichtigste Anwendung von 5-Aminotetrazol ist derzeit als N2-Gasgenerator in Airbags,[24][25] da es im Gegensatz zum früher verwendeten Natriumazid praktisch untoxisch, thermisch stabiler und wenig stoßempfindlich, sowie im Gegensatz zu dem von Takata[26] als Treibmittel verwendeten kostengünstigeren Ammoniumnitrat nicht hygroskopisch ist.
Literatur
- T. M. Klapötke: Chemie der hochenergetischen Materialien. de Gruyter, Berlin 2009, ISBN 978-3-11-020745-3.
Einzelnachweise
- Eintrag zu 5-Amino-1H-tetrazol bei TCI Europe, abgerufen am 9. Dezember 2017.
- Datenblatt 5-Aminotetrazole bei Sigma-Aldrich, abgerufen am 9. Dezember 2017 (PDF).
- J. Thiele: Ueber Nitro- und Amidoguanidin. In: Justus Liebigs Ann. Chem. Band 270, Nr. 1–2, 1892, S. 1–63, doi:10.1002/jlac.18922700102.
- Patent DE65584: Verfahren zur Darstellung von Amidotetrazotsäure. Angemeldet am 20. September 1891, veröffentlicht am 4. November 1892, Anmelder: J. Thiele, Erfinder: J. Thiele.
- A. Hantzsch, A. Vagt: Ueber das sogenannte Diazoguanidin. In: Justus Liebigs Ann. Chem. Band 314, Nr. 3, 1901, S. 339–369, doi:10.1002/jlac.19013140307.
- Patent DE426343: Verfahren zur Darstellung von Aminotetrazol. Angemeldet am 12. Juli 1924, veröffentlicht am 6. März 1926, Anmelder: J. Thiele, Erfinder: R. Stollé, E. Schick.
- J.S. Minhina, R.M. Herbst: The reaction of nitriles with hydrazoic acid: Synthesis of monosubstituted tetrazoles. In: J. Org. Chem. Band 15, Nr. 5, 1950, S. 1082–1092, doi:10.1021/jo01151a027.
- Patent US5424449: Process for the preparation of 5-aminotetrazole. Angemeldet am 28. Oktober 1994, veröffentlicht am 13. Juni 1995, Anmelder: Olin Corp., Erfinder: E.F. Rothgery, K.O. Knollmueller.
- Patent US5594146: Process for producing 5-aminotetrazole. Angemeldet am 22. Februar 1995, veröffentlicht am 14. Januar 1997, Anmelder: Nippon Carbide Kogyo K.K., Erfinder: M. Murotani, H. Mura, M. Taneka, H. Shibafuchi.
- R. Raap: Amination of tetrazoles with hydroxylamine-O-sulfonic acid: 1- and 2-aminotetrazoles. In: Can. J. Chem. Band 47, Nr. 19, 1969, S. 3677–3681, doi:10.1139/v69-606.
- T.M. Klapötke, D.G. Piercey, J. Stierstorfer: Amination of energetic anions: high-performing energetic materials. In: Dalton Trans. Band 41, Nr. 31, 2012, S. 9451–9459, doi:10.1039/C2DT30684K.
- H. Gao, J.M. Shreeve: Azole-based energetic salts. In: Chem. Rev. Band 111, Nr. 11, 2011, S. 7377–7436, doi:10.1021/cr200039c.
- G.-H. Tao, Y. Guo, Y.-H. Joo, B. Twamley, J.M. Shreeve: Energetic nitrogen-rich salts and ionic liquids: 5-aminotetrazole (AT) as a weak acid. In: J. Mater. Chem. Band 18, 2008, S. 5524–5530, doi:10.1039/b811506k.
- R.A. Henry, W.G. Finnegan: An improved process for the deamination of 5-aminotetrazole. In: J. Am. Chem. Soc. Band 76, Nr. 1, 1954, S. 290–291, doi:10.1021/ja01630a086.
- R.A. Henry, W.G. Finnegan: Mono-alkylation of sodium 5-aminotetrazole in aqueous media. In: J. Am. Chem. Soc. Band 76, Nr. 3, 1954, S. 923–926, doi:10.1021/ja01632a094.
- R.M. Herbst, C.W. Roberts, E.J. Harvill: The synthesis of 5-aminotetrazole derivatives. In: J. Org. Chem. Band 16, Nr. 1, 1951, S. 139–149, doi:10.1021/jo01141a021.
- Patent US5646292: Blowing agents of tetrazoles and their derivatives. Angemeldet am 6. Mai 1996, veröffentlicht am 8. Juli 1997, Anmelder: Toyo Kasei Kogyo Co. Ltd., Erfinder: S. Nakagawa, H. Ogawa, H. Tanaka, A. Onishi.
- F. Einberg: Alkylation of 5-substituted tetrazoles with α-chlorocarbonyl compounds. In: J. Org. Chem. Band 35, Nr. 11, 1970, S. 3978–3980, doi:10.1021/jo00836a095.
- Y.-H. Joo et al.: Energetic salts based on nitroiminotetrazole-containing acetic acid. In: J. Mater. Chem. Band 22, Nr. 13, 2012, S. 6123–6130, doi:10.1039/C2JM30322A.
- G. Höfle, B. Lange: Oxidation of 5-aminotetrazoles: Benzyl isocyanide In: Organic Syntheses. 61, 1983, S. 14, doi:10.15227/orgsyn.061.0014; Coll. Vol. 7, 1990, S. 27 (PDF).
- G.P. Kantin, M. Krasavin: Reaction of α-tetralone, 1H-tetrazol-5-amine, and aromatic aldehydes upon microwave irradiation – a convenient method for the synthesis of 5,6,7,12-tetrahydrobenzo[h]tetrazolo[5,1-b]quinazolines. In: Chem. Heterocycl. Compd. Band 52, Nr. 11, 2016, S. 918–922, doi:10.1007/s10593-017-1985-0.
- A. Taden, A.H. Tait, A. Kraft: Synthesis and polymerization of 5-(methacrylamido)tetrazole, a water-soluble acidic monomer. In: J. Polym. Sci., Part A. Band 40, Nr. 23, 2002, S. 4333–4343, doi:10.1002/pola.10509.
- D. Fischer, T.M. Klapötke, D.G. Piercey, J. Stiersdorfer: Synthesis of 5-aminotetrazole-1N-oxide and its azo derivative: A key step in the development of new energetic materials. In: Chemistry – A European Journal. Band 19, Nr. 14, 2013, S. 4602–4613, doi:10.1002/chem.201203493.
- Patent EP0519485A1: Treibmittel für Gasgeneratoren. Angemeldet am 19. Juni 1992, veröffentlicht am 23. Dezember 1992, Anmelder: Dynamit Nobel AG, Erfinder: K. Redecker, W. Weuter.
- Patent US20090020197A1: Gas generating compositions and airbag inflators. Angemeldet am 16. Juli 2007, veröffentlicht am 22. Januar 2009, Anmelder: Key Safety Systems, Inc., Erfinder: E.O. Hosey.
- A Cheaper Airbag, and Takata’s Road to a Deadly Crisis. The New York Times, 26. August 2016, abgerufen am 8. Januar 2018.
