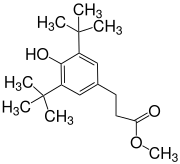
3-(3,5-Di-tert-butyl-4-hydroxyphenyl)propionsäuremethylester
3-(3,5-Di-tert-butyl-4-hydroxyphenyl)propionsäuremethylester (Metilox) ist ein Derivat der 4-Hydroxyzimtsäure, die zur 3-(4-Hydroxyphenyl)propansäure (4-Hydroxydihydrozimtsäure) hydriert und zum Methylester verestert ist. Als sterisch gehindertes Phenol hat Metilox antioxidative Eigenschaften und ist Ausgangsverbindung für längerkettige und komplexere Ester und Amide, die u. a. als Stabilisatoren für Polymere eingesetzt werden.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-(3,5-Di-tert-butyl-4-hydroxyphenyl)propionsäuremethylester | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C18H28O3 | ||||||||||||||||||
| Kurzbeschreibung |
weißes Kristallpulver[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 292,42 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,09 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
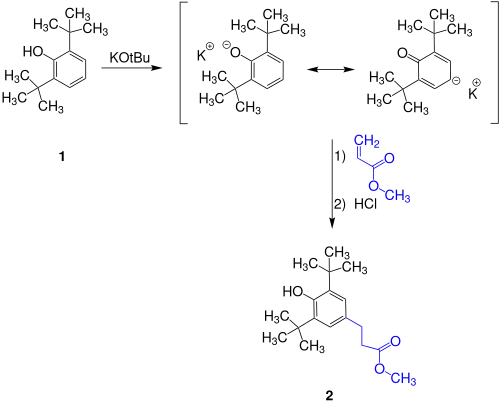
Herstellung
Bei der Synthese von Methyl-di-tert-butylhydroxyhydrocinnamat (2) wird mit Kalium-tert-butanolat aus 2,6-Di-tert-butylphenol (1) das mesomere Anion erzeugt, das in seiner Carbanion-Form in einer Michael-Addition mit Acrylsäuremethylester reagiert. Nach Ansäuern kann das Produkt mittels Vakuumdestillation als gelbliches Öl isoliert werden, das zu einem weißen Feststoff erstarrt.[3]
Eigenschaften
3-(3,5-Di-tert-butyl-4-hydroxyphenyl)propionsäuremethylester ist ein weißer Feststoff, der bei der Synthese zunächst als gelbliches Öl anfällt. Die Verbindung ist praktisch wasserunlöslich, löst sich aber in vielen organischen Lösungsmitteln. Problematisch ist seine schlechte Bioabbaubarkeit, wenn es als Bestandteil von flüssigen Gemischen in die Umgebung gelangen sollte.
Anwendungen
Wie seine Ausgangsverbindung 2,6-Di-tert-butylphenol ist auch 3-(3,5-Di-tert-butyl-4-hydroxyphenyl)propionsäuremethylester als Radikalfänger als Antioxidans in Polymeren, insbesondere in Polyolefinen und Polyurethanen wirksam. Außerdem wird es in technischen Ölen, wie z. B. Motorölen, Schmierölen und Getriebeölen, in Hydraulikflüssigkeiten und Kühlschmiermitteln (englisch metal working fluids, MWF) eingesetzt. Metilox ist Zwischenstufe für eine Reihe von gehinderten Phenolen mit längeren Alkylketten oder räumlich sperrigeren Strukturen, um Flüchtigkeit und Diffusion in Polymeren herabzusetzen und Fogging, insbesondere in Fahrzeuginnenräumen und Wohnräumen, zu unterdrücken.
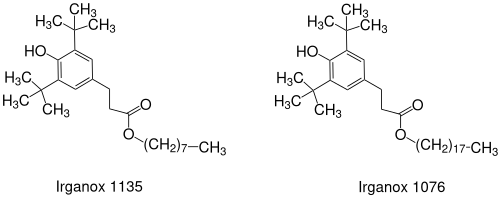
Die höheren Ester von Metilox (Octyl = Irganox 1135, Octadecyl = Irganox 1076, Pentaerythrityl = Irganox 1010) werden meistens durch Umesterung mit dem jeweiligen Alkohol unter Katalyse mit z. B. Alkalihydroxiden, wie Lithiumhydroxid[6] oder mit organischen Zinnverbindungen, wie Dibutylzinnoxid[7][8] erzeugt.
Die Michael-Addition höherer Acrylsäureester, wie z. B. Octadecylacrylat an 2,6-Di-tert-butylphenol analog der Metilox-Synthese ist ebenfalls erwähnt[3], aber technisch nicht relevant.
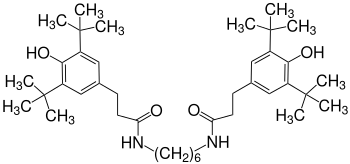
Amide (statt Ester) wie das Diamid des 1,6-Diaminohexans (Irganox 1098)[9] eignen sich besonders zur Stabilisierung von Polyamiden, wie z. B. Polyamid 6.
Die möglichst effiziente Stabilisierung von Polymeren gegen durch Licht und Hitze initiierten oxidativen Abbau erfordert in der Regel die Zugabe von Alterungsschutzmitteln als Gemische (so genannte „stabilizer packages“) aus gehinderten Phenolen und anderen Verbindungen, wie den ebenfalls antioxidativ wirksamen Phosphonaten, Radikalfängern wie HALS (hindered amine light stabilizers) und UV-Absorbern wie Benzophenonen, Benzotriazolen oder Hydroxyphenyltriazinen.
Literatur
- George Wypych (Hrsg.): Handbook of UV Degradation and Stabilization, 2nd Edition. ChemTec Publishing, Toronto 2015, ISBN 978-1-895198-86-7.
Einzelnachweise
- Eintrag zu METHYL DI-T-BUTYL HYDROXYHYDROCINNAMATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. September 2021.
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Metilox, abgerufen am 15. Juni 2018.
- Patent US3364250: Methyl β-(3,5-di-tert-butyl-4-hydroxy-phenyl)propionate. Angemeldet am 22. Oktober 1965, veröffentlicht am 16. Januar 1968, Anmelder: Geigy Corp., Erfinder: M. Dexter, E.A. Meier.
- Eintrag zu Methyl 3-(3,5-di-tert-butyl-4-hydroxyphenyl)propionate bei Toronto Research Chemicals, abgerufen am 1. Oktober 2018 (PDF).
- fluorochem: MSDS Methyl 3-(3,5-di-tert-butyl-4-hydroxyphenyl)-propionate, abgerufen am 25. Juni 2018.
- Patent US7985871B2: Preparation of tetrakis[3(3,5-di-tert-butyl-4-hydroxyphenyl)propionyloxymethyl]methane. Angemeldet am 6. August 2009, veröffentlicht am 26. Juli 2011, Anmelder: Chemtura Corp., Erfinder: J.S. Hill.
- Patent US4594444: Process for the preparation of sterically hindered hydroxyphenylcarboxylic acid esters. Angemeldet am 12. Dezember 1984, veröffentlicht am 10. Juni 1986, Anmelder: Ciba-Geigy Corp., Erfinder: I. Orban.
- Patent EP0808818A1: Process for the preparation of substituted hydroxy-hydrocinnamate esters. Angemeldet am 16. Mai 1997, veröffentlicht am 26. November 1997, Anmelder: Ciba Specialty Chemicals Holding Inc., Erfinder: M.E. Schultz, B. Dubuis, P. Küng, J.R. Ross.
- Patent US3677965: Alkylhydroxyphenyl polyamides as antioxidants. Angemeldet am 29. Dezember 1967, veröffentlicht am 18. Juli 1972, Anmelder: Geigy Corp., Erfinder: M. Dexter, B. Manor, J.D. Spivack, D.H. Steinberg.
