2,6-Lutidin
Das 2,6-Lutidin (2,6-Dimethylpyridin) ist eine organische Verbindung, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Es besteht aus einem Pyridinring, der mit zwei Methylgruppen substituiert ist. Es gehört zur Stoffgruppe der Lutidine, einer Gruppe von sechs Konstitutionsisomeren mit der Summenformel C7H9N.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
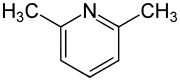 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2,6-Lutidin | |||||||||||||||
| Andere Namen |
2,6-Dimethylpyridin (IUPAC) | |||||||||||||||
| Summenformel | C7H9N | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit unangenehmem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 107,16 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,923 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
144 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert |
6,60 (25 °C)[2] | |||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | |||||||||||||||
| Brechungsindex |
1,4953 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Das 2,6-Lutidin wurde aus Steinkohlenteer[4] und Knochenöl isoliert.[5] Es besitzt einen charakteristischen nussartigen Geruch.
Die Darstellung erfolgt analog der Hantzschschen Dihydropyridinsynthese aus Acetessigsäureethylester (als β-Ketocarbonylverbindung), Formaldehyd und Ammoniak im Verhältnis 2:1:1 in Gegenwart von etwas Diethylamin.[6] Durch Oxidation der Methylgruppen entsteht die Dipicolinsäure.
In der organischen Synthese dient das 2,6-Lutidin als sterisch gehinderte Base, beispielsweise bei der Schützung von Alkoholen als Silylether.[7]
Einzelnachweise
- Eintrag zu 2,6-Lutidin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Juli 2017. (JavaScript erforderlich)
- Zvi Rappoport: CRC Handbook of Tables for Organic Compound Identification, Third Edition, CRC Press, Boca Raton, Florida, 1984, ISBN 0-8493-0303-6, S. 438.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-210.
- G. Lunge, J. Rosenberg: Ueber die Lutidine des Steinkohlentheers, in: Berichte der deutschen chemischen Gesellschaft, 1887, 20, S. 127–137 (doi:10.1002/cber.18870200132).
- A. Ladenburg, C. F. Roth: Studien über das käufliche Picolin, in: Berichte der deutschen chemischen Gesellschaft, 1885, 18, S. 47–54, hier S. 51 (doi:10.1002/cber.18850180110).
- Alvin Singer, S. M. McElvain: 2,6-Dimethylpyridine In: Organic Syntheses. 14, 1934, S. 30, doi:10.15227/orgsyn.014.0030; Coll. Vol. 2, 1943, S. 214 (PDF).
- Eintrag zu Lutidine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Juli 2017.
Weblinks
- Eintrag zu 2,6-Lutidin. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD

