Dipicolinsäure
Dipicolinsäure (Pyridin-2,6-dicarbonsäure) ist eine organische Verbindung, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Sie gehört zur Gruppe der Pyridindicarbonsäuren und besteht aus einem Pyridinring, der zwei Carboxygruppen in 2- und 6-Position trägt. Der Name leitet sich von der Picolinsäure (Pyridin-2-carbonsäure) ab, die am Pyridinring nur eine Carboxygruppe in 2-Position trägt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
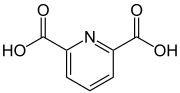 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Dipicolinsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C7H5NO4 | |||||||||||||||||||||
| Kurzbeschreibung | ||||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 167,10 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen und Darstellung
Die Verbindung ist eine Substanz, die während der Sporulation (Sporenbildung) von Mikroorganismen gebildet wird. Sie kommt nur im Kern (Sporenprotoplasten) von Endosporen (5–15 % des Trockengewichts) vor, ist jedoch nicht in vegetativen Zellen enthalten.
Eine Darstellung erfolgt z. B. aus 2,6-Lutidin durch Oxidation der Methylgruppen.
Eigenschaften
Beim Erhitzen zersetzt sie sich ab 248 °C durch Decarboxylierung zu Picolinsäure:[3]
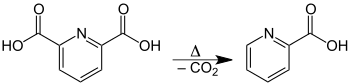
Biologische Bedeutung
Dipicolinsäure ist verantwortlich für die Thermoresistenz einiger Bakterien[5][6][7] und liegt oft als Chelat mit Calciumionen (Ca2+) vor.[8]
Verwendung
Dipicolinsäure wird in der chemischen Industrie für die Vorbereitung von mit Dipicolin gebundenen Lanthanoiden (als Chelatligand) und als Komplexbildner für Übergangsmetallkomplexe[9][10] sowie als Stabilisator für Peroxide[11] und als Zwischenprodukt zur Herstellung weiterer chemischer Verbindungen verwendet.
Weblinks
- Sigma-Aldrich: FT-IR Raman Spektrum (PDF; 21 kB).
Einzelnachweise
- Eintrag zu 2,6-DICARBOXYPYRIDINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 27. Juni 2020.
- Eintrag zu Dipicolinsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Juli 2014.
- Eintrag zu Pyridin-2,6-dicarbonsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- D'Ans-Lax: Taschenbuch für Chemiker und Physiker. 3. Auflage, Band 1, Springer-Verlag, Berlin-Göttingen-Heidelberg 1967 (ChemieOnline – pKb- und pKs-Werte).
- H. Höffeler: Bildatlas Cytologie. Harri Deutsch Verlag, Frankfurt/Main 2003, ISBN 3-8171-1685-3, S. 39.
- Rainer Bültermann: Untersuchungen zur Hitzeresistenz von Bakteriensporen und zum Pasteurisieren von oberflächlich verkeimten Lebensmitteln. Karlsruhe 1997, DNB 1014057590, urn:nbn:de:swb:90-AAA3161973 (Dissertation, Universität Karlsruhe).
- Jörg Fichtel: Bestimmung des Endosporenanteils an der mikrobiellen Lebensgemeinschaft in Wattsedimenten: = Determination of the abundance of endospores within the microbial community in tidal flat sediments. Oldenburg 2008, DNB 989264467, urn:nbn:de:gbv:715-oops-7657 (Dissertation, Universität Oldenburg).
- A. Steinbüchel, F. B. Oppermann-Sanio: Mikrobiologisches Praktikum. Versuche und Theorie. Springer Verlag, Berlin 2003, ISBN 3-540-44383-5, S. 59.
- Datenblatt Dipicolinsäure bei Sigma-Aldrich, abgerufen am 31. März 2010 (PDF).
- Sabrina Dehn: Enantiomerenreine β-Diketonate [Beta-Diketonate] für lumineszierende helicat-artige Komplexe. Aachen 2007, DNB 98372718X, urn:nbn:de:hbz:82-opus-18115 (Dissertation, RWTH Aachen).
- Patent EP0742206: Percarboxylic acid solutions with improved stability in presence steel. Veröffentlicht am 29. September 1999, Erfinder: Georg Thiele, Peter Täubl.
