δ-Decalacton
δ-Decalacton ist eine organisch-chemische Verbindung und gehört zu der Klasse der Lactone. Es kommt als Aromastoff in Lebensmitteln[2] – insbesondere Milchprodukten – vor und ist ein Schlüsselaromastoff von Butter.[5]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
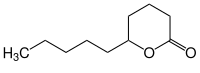 | |||||||||||||||||||
| Struktur ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | δ-Decalacton | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C10H18O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, viskose Flüssigkeit mit milchig-sahnigem Aroma[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 170,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[3] | ||||||||||||||||||
| Dichte |
0,954 g·cm−3 (25 °C)[3] | ||||||||||||||||||
| Schmelzpunkt |
−27 °C[4] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser (4 g·l−1 bei 28 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Isomere
δ-Decalacton kommt in zwei enantiomeren Formen [(R)-δ-Decalacton und (S)-δ-Decalacton] vor. Das 1:1-Gemisch beider Verbindung, das Racemat, wird als (RS)-δ-Decalacton bezeichnet.
| Isomere von δ-Decalacton | ||
| Name | (S)-δ-Decalacton | (R)-δ-Decalacton |
| Strukturformel | -Decalactone.svg.png.webp) |
-Decalactone.svg.png.webp) |
| CAS-Nummer | 59285-67-5 | 2825-91-4 |
| 705-86-2 (Racemat) | ||
| EG-Nummer | – | – |
| 211-889-1 (Racemat) | ||
| ECHA-Infocard | – | – |
| 100.010.810 (Racemat) | ||
| PubChem | 6566010 | 1714996 |
| 12810 (Racemat) | ||
| FL-Nummer | 10.007 (Racemat) | |
| Wikidata | Q27273761 | Q27256617 |
| Q27159530 (Racemat) | ||
Vorkommen

δ-Decalacton kommt in verschiedenen Lebensmitteln als Aromastoff vor. Es ist einer der wichtigsten Bestandteile des Butteraromas und trägt auch zum Aroma weiterer Milchprodukte wie H-Milch und verschiedenen Käsen bei.[5] Daneben kommt es auch in verschiedenen Früchten wie Pfirsich, Aprikose, Kokosnuss oder Himbeere vor.[2] In Fleisch sorgt es für ein Fehlaroma.[6]
In den meisten Quellen außer Himbeeren liegt größtenteils die (R)-Form vor.[2]
Gewinnung und Darstellung
In der Natur entsteht δ-Decalacton in mehreren Schritten aus Linolsäure. Dabei wird die Kohlenstoffkette durch β-Oxidation verkürzt. Der direkte Vorläufer des δ-Decalactons ist die 5-Hydoxydecansäure, die unter Ringschluss innermolekular verestert wird.[6] Industriell kann δ-Decalacton zum Beispiel durch Fermentation aus Massoia-Öl, einem Öl aus der Rinde des tropischen Baumes Cryptocarya massoia, hergestellt werden.[7]
δ-Decalacton (2) wird industriell auch synthetisch hergestellt werden. Es entsteht durch die Oxidation von 2-Pentylcyclopentanon (1) mit einer Peroxycarbonsäure (Baeyer-Villiger-Oxidation). Die Konfiguration des Ketons bleibt dabei im Lacton erhalten.[8]
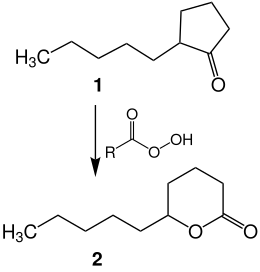
Eigenschaften
Aromaeigenschaften
Der Geruch und Geschmack der beiden Enantiomere unterscheiden sich nicht stark voneinander.[2] Wie bei allen Aromastoffen ist die Wahrnehmung unterschiedlich. δ-Decalacton wird in Geschmack und Geruch als kräftig[9], süß[9], cremig[9][7], kokusnussartig[9][7], fruchtig[9] und pfirsichartig[7] wahrgenommen. Andererorts wird das Aroma als milchig-sahnig beschrieben.[2]
Die Geruchsschwelle von δ-Decalacton liegt bei 100 μg/kg Wasser.[6]
Chemische Eigenschaften
Aus δ-Decalacton kann durch Ringöffnende Polymerisation der Polyester Poly-δ-decalacton hergestellt werden. Auch eine Copolymerisation mit anderen Monomeren ist möglich.[10][11]
Verwendung
δ-Decalacton wird als Riechstoff in Parfums[2] und in Butter-, Sahne- und Käsearomen eingesetzt.[9]
Das Polymer Poly-δ-decalacton und einige Copolymere werden aktuell als mögliche bio-basierte Kunststoffe erforscht.[11][10] Es wird ein Potential dieser Polymere im Bereich des Drug Targeting gesehen.[12]
Einzelnachweise
- Eintrag zu DELTA-DECALACTONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 22. Oktober 2021.
- Eintrag zu Decanolactone. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. November 2019.
- Datenblatt δ-Decalactone natural, ≥98%, FCC, FG bei Sigma-Aldrich, abgerufen am 26. November 2019 (PDF).
- Eintrag zu Decan-5-olid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. November 2019. (JavaScript erforderlich)
- Hans-Dieter Belitz, Werner Grosch & Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6. Auflage. Springer, Berlin 2008, ISBN 978-3-540-73201-3, 10.3, S. 557–563, doi:10.1007/978-3-540-73202-0.
- Hans-Dieter Belitz, Werner Grosch & Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6. Auflage. Springer, Berlin 2008, ISBN 978-3-540-73201-3, 5.2.3.2, S. 387–389, doi:10.1007/978-3-540-73202-0.
- Jens Schrader: Microbial Flavour Production. In: Ralf Günter Berger (Hrsg.): Flavours and Fragrances - Chemistry, Bioprocessing and Sustainability. Springer, Berlin 2007, ISBN 978-3-540-49338-9, 23.4.4, S. 556–557, doi:10.1007/b136889.
- Avelino Corma, Sara Iborra, MarÌa Mifsud, Michael Renz & Manuel Susarte: A New Environmentally Benign Catalytic Process for the Asymmetric Synthesis of Lactones: Synthesis of the Flavouring δ-Decalactone Molecule. In: Advanced Synthesis & Catalysis. Band 346, 2004, S. 257–262, doi:10.1002/adsc.200303234.
- Bettina Muermann & Uwe-Jens Salzer: Aromen-Lexikon. Behr's Verlag, 2015, ISBN 978-3-95468-359-8, S. 47 (eingeschränkte Vorschau in der Google-Buchsuche).
- Mark T. Martello, Adam Burns & Hillmyer: Bulk Ring-Opening Transesterification Polymerization of the Renewable δ-Decalactone Using an Organocatalyst. In: ACS Macro Letters. Band 1, 2012, S. 131–135, doi:10.1021/mz200006s.
- Deborah K. Schneiderman, Chad Gilmer, Michael T. Wentzel, Mark T. Martello, Tomohiro Kubo & Jane E. Wissinger: Sustainable Polymers in the Organic Chemistry Laboratory: Synthesis and Characterization of a Renewable Polymer from δ‑Decalactone and L‑Lactide. In: Journal of Chemical Education. Band 91, 2014, S. 131–135, doi:10.1021/ed400185u.
- Kuldeep K. Bansal, Deepak Kakde, Laura Purdie, Derek J. Irvine, Steven M. Howdle, Giuseppe Mantovani & Cameron Alexander: New biomaterials from renewable resources – amphiphilic block copolymers from δ-decalactone. In: Polymer Chemistry. Band 6, 2015, S. 7196–7210, doi:10.1039/c5py01203a.