β2-Adrenozeptor
Der β2-Adrenozeptor, häufig auch β2-adrenerger Rezeptor genannt, ist ein Zellmembran-ständiges Protein aus der zur Familie der G-Protein-gekoppelten Rezeptoren gehörenden Beta-Adrenozeptoren. Es ist neben dem Sehpigment Rhodopsin das bestuntersuchte Protein dieser Familie. Der β2-Adrenozeptor wird durch das Hormon Adrenalin und Isoprenalin aktiviert und ist unter anderem für dessen die glatte Muskulatur entspannende, Glucose freisetzende und muskelanabole Wirkung verantwortlich.
| β2-Adrenozeptor | ||
|---|---|---|
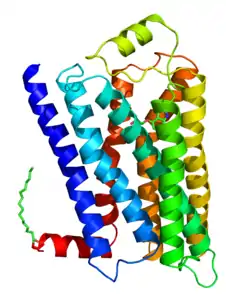 | ||
| 3D-Strukturmodell des β2-Adrenozeptors mit dem inversen Agonisten Carazolol | ||
|
Vorhandene Strukturdaten: PDB 2RH1, PDB 3P0G, PDB 3PDS, PDB 3NY8, PDB 3NY9, PDB 3NYA, PDB 3KJ6, PDB 2R4R, PDB 2R4S | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 413 AS; 46,5 kDa | |
| Sekundär- bis Quartärstruktur | 7TM | |
| Bezeichner | ||
| Gen-Namen | ADRB2 , ADRB2R, B2AR | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Wirbeltiere | |
Vorkommen
Der β2-Adrenozeptor kann bei vielen Vertretern des Unterstamms der Wirbeltiere nachgewiesen werden und kommt bei den Vertretern der Klasse der Säugetiere ubiquitär vor. Die entwicklungsgeschichtliche Entstehung der β2-Adrenozeptoren und die Abspaltung zu anderen β-Adrenozeptoren durch Genverdopplung kann auf das späte Neoproterozoikum oder das frühe Paläozoikum extrapoliert werden.[1]
Im menschlichen Organismus ist der β2-Adrenozeptor weit verbreitet und findet sich insbesondere auf den Zellmembranen der Zellen der glatten Muskulatur, der Nervenzellen und der Fettzellen. Neben dem dominierenden β1-Adrenozeptor kommt er in großer Menge auch im Herz vor.[2]
Biochemie
Genetik
Der β2-Adrenozeptor wird durch das intronfreie ADRB2-Gen codiert.[3] Das ADRB2-Gen des Menschen liegt auf dem Chromosom 5 im Genlocus 5q31-q32. Polymorphismen und Punktmutationen des Gens werden unter anderem mit Asthma[4], Übergewicht[5] und Herz-Kreislauf-Erkrankungen in Verbindung gebracht.[6]
Struktur
Der β2-Adrenozeptor ist einer der wenigen G-Protein-gekoppelten Rezeptoren, dessen Struktur mit Hilfe der Röntgenkristallographie aufgeklärt werden konnte. Für ihn liegen Strukturdaten sowohl für den aktiven als auch den inaktiven Zustand vor, die nach Stabilisierung durch Fusion mit dem relativ leicht zu kristallisierenden Lysozym der T4-Phage (T4-Lysozym)[7] oder durch Komplexierung mit Hilfe von Fab-Antikörperfragmenten[8] oder Einzeldomänenantikörpern[9] gewonnen wurden. Als charakteristisches Motiv trägt der β2-Adrenozeptor, wie alle anderen bekannten G-Protein-gekoppelten Rezeptoren, sieben die Zellmembran durchspannende α-Helices. Wie beim Rhodopsin schließt sich eine achte α-Helix an das intrazelluläre Ende der transmembranären Helix 7 an. Zusätzlich verfügt der β2-Adrenozeptor über ein weiteres α-helikales Strukturmotiv, welches sich extrazellulär zwischen den Transmembranhelices 4 und 5 befindet. Eine Ligandenbindungsstelle, an die der körpereigene Ligand Adrenalin und zahlreiche Arzneistoffe binden, liegt auf der zelläußeren Seite der Transmembranhelices. Die zellinneren Schleifen hingegen tragen Bindungsstellen für die an der Signalweiterleitung beteiligten Effektorproteine, insbesondere G-Proteine.
Rezeptoraktivierung
Der β2-Adrenozeptor wird durch Bindung seines körpereigenen Liganden Adrenalin aktiviert. In geringerem Maße, das heißt mit einer etwa 30-fach geringeren Affinität, bindet und aktiviert auch das überwiegend als Neurotransmitter fungierende Noradrenalin diesen Rezeptor. Durch die Bindung dieser Liganden wird der aktive Zustand des Rezeptors stabilisiert. In diesem Zustand ist der Rezeptor in der Lage, intrazellulär gebundene G-Proteine zu aktivieren und somit eine Signaltransduktionskaskade zu starten. Über den β2-Adrenozeptor werden bevorzugt Gs-Proteine aktiviert, welche ihrerseits Adenylylcyclasen aktivieren und den intrazellulären cAMP-Spiegel erhöhen. Aber auch G-Proteine der Familie Gi/o können mit diesen Rezeptor koppeln. Zusätzliche Interaktionspartner des β2-Adrenozeptors sind beispielsweise β-Arrestin und G-Protein-gekoppelte Rezeptorkinasen.
Funktion
Der β2-Adrenozeptor ist hauptverantwortlich für die Relaxation der glatten Muskulatur durch Adrenalin. So führt eine Aktivierung von β2-Adrenozeptor beispielsweise zu einer Relaxation der Bronchien, des Uterus und des Darms. In den Blutgefäßen ist der β2-Adrenozeptor der dominierende β-Adrenozeptor. Er ist auch hier für die relaxierende Wirkkomponente des Adrenalins hauptverantwortlich und somit ein Gegenspieler der α1-Adrenozeptoren. An der Vasorelaxation sind nicht nur die β2-Adrenozeptoren der glatten Muskulatur der Blutgefäße, sondern auch die der Stickstoffmonoxid freisetzenden Endothelzellen beteiligt.[10]
Pharmakologie
Der β2-Adrenozeptor ist eine der pharmakologisch bedeutsamsten Zielstrukturen für die Arzneistoffentwicklung. Neben den körpereigenen Liganden Adrenalin und Noradrenalin finden insbesondere synthetische Agonisten eine therapeutische Anwendung. Diese werden, wie beispielsweise Clenbuterol, Fenoterol, Reproterol, Salbutamol, Salmeterol und Terbutalin, zur Behandlung des Asthma bronchiale und anderer Atemwegserkrankungen eingesetzt. In der Geburtsmedizin werden β2-Adrenozeptoragonisten, wie beispielsweise Fenoterol, als Tokolytika eingesetzt. Die lipolytische und muskelanabole Wirkung der β2-Adrenozeptoragonisten findet bei der Tierzucht und beim Doping im Leistungssport eine illegale Anwendung.
Im Gegensatz zu den Agonisten besitzen selektive Antagonisten des β2-Adrenozeptors keine therapeutische Bedeutung. Nichtselektive Betablocker, die sowohl β1- als auch β2-Adrenozeptoren blockieren, wie beispielsweise Propranolol, finden in der Therapie des Bluthochdrucks, der Herzinsuffizienz und der koronaren Herzkrankheit Anwendung.
Einzelnachweise
- Aris-Brosou S, Chen X, Perry SF, Moon TW: Timing of the functional diversification of alpha- and beta-adrenoceptors in fish and other vertebrates. In: Ann. N. Y. Acad. Sci.. 1163, April 2009, S. 343–347. doi:10.1111/j.1749-6632.2009.04451.x. PMID 19456356.
- Brodde OE, Bruck H, Leineweber K: Cardiac adrenoceptors: physiological and pathophysiological relevance. In: J Pharmacol Sci. 100, Nr. 5, 2006, S. 323–337. PMID 16612046.
- Kobilka BK, Dixon RA, Frielle T, et al.: cDNA for the human beta 2-adrenergic receptor: a protein with multiple membrane-spanning domains and encoded by a gene whose chromosomal location is shared with that of the receptor for platelet-derived growth factor. In: Proc. Natl. Acad. Sci. U.S.A.. 84, Nr. 1, Januar 1987, S. 46–50. PMID 3025863. PMC 304138 (freier Volltext).
- Turki J, Pak J, Green SA, Martin RJ, Liggett SB: Genetic polymorphisms of the beta 2-adrenergic receptor in nocturnal and nonnocturnal asthma. Evidence that Gly16 correlates with the nocturnal phenotype. In: J. Clin. Invest.. 95, Nr. 4, April 1995, S. 1635–1641. doi:10.1172/JCI117838. PMID 7706471. PMC 295666 (freier Volltext).
- Large V, Hellström L, Reynisdottir S, et al.: Human beta-2 adrenoceptor gene polymorphisms are highly frequent in obesity and associate with altered adipocyte beta-2 adrenoceptor function. In: J. Clin. Invest.. 100, Nr. 12, Dezember 1997, S. 3005–3013. doi:10.1172/JCI119854. PMID 9399946. PMC 508512 (freier Volltext).
- Eisenach JH, Wittwer ED: β-Adrenoceptor gene variation and intermediate physiological traits: prediction of distant phenotype. In: Exp. Physiol.. 95, Nr. 7, Juli 2010, S. 757–764. doi:10.1113/expphysiol.2009.048330. PMID 20382665.
- Cherezov V, Rosenbaum DM, Hanson MA, et al.: High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor. In: Science. 318, Nr. 5854, November 2007, S. 1258–1265. doi:10.1126/science.1150577. PMID 17962520. PMC 2583103 (freier Volltext).
- Rasmussen SG, Choi HJ, Rosenbaum DM, et al.: Crystal structure of the human beta2 adrenergic G-protein-coupled receptor. In: Nature. 450, Nr. 7168, November 2007, S. 383–387. doi:10.1038/nature06325. PMID 17952055.
- Rasmussen SG, Choi HJ, Fung JJ, et al.: Structure of a nanobody-stabilized active state of the β(2) adrenoceptor. In: Nature. 469, Nr. 7329, Januar 2011, S. 175–180. doi:10.1038/nature09648. PMID 21228869.
- Guimarães S, Moura D: Vascular adrenoceptors: an update. In: Pharmacol. Rev.. 53, Nr. 2, Juni 2001, S. 319–56. PMID 11356987.