β1-Adrenozeptor
Der β1-Adrenozeptor, häufig auch β1-adrenerger Rezeptor genannt, ist ein Zellmembran-ständiges Protein aus der zur Familie der G-Protein-gekoppelten Rezeptoren gehörenden Beta-Adrenozeptoren. Er wird durch das Hormon Adrenalin aktiviert und ist unter anderem für dessen Wirkung auf das Herz verantwortlich. Der β1-Adrenozeptor ist das molekulare Ziel einer der bedeutsamsten Gruppen von Arzneistoffen, den Betablockern.
| β1-Adrenozeptor | ||
|---|---|---|
.png.webp) | ||
| 3D-Strukturmodell des β1-Adrenozeptors mit gebundenen Agonisten Isoprenalin basierend auf Kristallstrukturdaten | ||
|
Vorhandene Strukturdaten: PDB 2Y00, PDB 2Y01, PDB 2Y02, PDB 2Y03, PDB 2Y04, PDB 2VT4 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 477 AS; 51,3 kDa | |
| Sekundär- bis Quartärstruktur | 7TM | |
| Bezeichner | ||
| Gen-Namen | ADRB1 , ADRB1R, B1AR | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Wirbeltiere | |
Verbreitung im Tierreich
Der β1-Adrenozeptor zeigt eine weite Verbreitung innerhalb des Unterstamms der Wirbeltiere. Er konnte sowohl bei Fischen, Amphibien, Reptilien, Vögeln als auch bei Säugetieren nachgewiesen werden. Die entwicklungsgeschichtliche Entstehung der β1-Adrenozeptoren und die Abspaltung zu anderen β-Adrenozeptoren durch Genverdopplung kann auf das späte Neoproterozoikum oder das frühe Paläozoikum extrapoliert werden.[1]
Vorkommen und Funktion beim Menschen
Im menschlichen Organismus ist der β1-Adrenozeptor insbesondere im Herz zu finden. Im Herz ist er mit einem Anteil von 70 bis 80 % der dominierende β-Adrenozeptor.[2] Er ist hauptverantwortlich für die Kontraktilität erhöhende (positive Inotropie), Herzfrequenz erhöhende (positive Chronotropie), Erregungsleitung beschleunigende (positive Dromotropie) und Reizschwelle senkende Wirkung (positive Bathmotropie) des Adrenalins am Herz.
Der β1-Adrenozeptor findet sich auch auf Zellen in der Niere, den juxtaglomerulären Zellen. Über eine Stimulation kommt es zur Reninausschüttung.[3]
Genetik
Der β1-Adrenozeptor wird durch das intronfreie ADRB1-Gen codiert.[4] Das ADRB1-Gen des Menschen liegt auf dem Chromosom 10 im Genlocus 10q24-q26. Polymorphismen des Gens werden unter anderem mit Herzinsuffizienz und einer veränderten Wirksamkeit von Betablockern in Verbindung gebracht.[5]
Biochemie
Struktur
Der β1-Adrenozeptor war einer der ersten G-Protein-gekoppelten Rezeptoren, dessen Struktur mit Hilfe der Röntgenkristallographie aufgeklärt werden konnte.[6][7] Als charakteristisches Motiv trägt der β1-Adrenozeptor, wie alle anderen bekannten G-Protein-gekoppelten Rezeptoren, sieben die Zellmembran durchspannende α-Helices. Wie beim Rhodopsin schließt sich eine achte α-Helix an das intrazelluläre Ende der transmembranären Helix 7 an. Zusätzlich verfügt der β1-Adrenozeptor ähnlich dem β2-Adrenozeptor, über ein weiteres α-helikales Strukturmotiv, welches sich extrazellulär zwischen den Transmembranhelices 4 und 5 befindet. Eine Ligandenbindungsstelle, an die der körpereigene Ligand Adrenalin und zahlreiche Arzneistoffe binden, liegt auf der zelläußeren Seite der Transmembranhelices. Die zellinneren Schleifen hingegen tragen Bindungsstellen für die an der Signalweiterleitung beteiligten Effektorproteine, insbesondere G-Proteine.
Rezeptoraktivierung
Der β1-Adrenozeptor wird durch Bindung seiner körpereigenen Liganden Adrenalin und Noradrenalin aktiviert. Durch die Bindung eines agonistischen Liganden wird die Ligandenbindungsstelle kontrahiert und der aktive Zustand des Rezeptors stabilisiert.[8] In diesem Zustand ist der Rezeptor in der Lage, intrazellulär gebundene G-Proteine zu aktivieren und somit eine Signaltransduktionskaskade zu starten. Über den β1-Adrenozeptor werden bevorzugt Gs-Proteine aktiviert, welche ihrerseits Adenylylcyclasen aktivieren und den intrazellulären cAMP-Spiegel erhöhen.
Pharmakologie
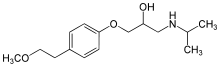
Der β1-Adrenozeptor ist einer der pharmakologisch bedeutsamsten Zielstrukturen für die Arzneistoffentwicklung. Antagonisten des β1-Adrenozeptors, die sogenannten Betablocker, zu denen unter anderem die Arzneistoffe Atenolol, Bisoprolol, Carvedilol, Metoprolol, Nebivolol, Propranolol, Sotalol und Timolol gehören, werden insbesondere in der Therapie des Bluthochdrucks, der koronaren Herzkrankheit, der Herzinsuffizienz, von Herzrhythmusstörungen und der Migräne eingesetzt.
β1-Adrenozeptoragonisten, wie Adrenalin, Noradrenalin und Dobutamin werden in der Anästhesie sowie intensiv- und notfallmedizinisch verwendet.
Einzelnachweise
- Aris-Brosou S, Chen X, Perry SF, Moon TW: Timing of the functional diversification of alpha- and beta-adrenoceptors in fish and other vertebrates. In: Ann. N. Y. Acad. Sci.. 1163, April 2009, S. 343–347. doi:10.1111/j.1749-6632.2009.04451.x. PMID 19456356.
- Jahns R, Boivin V, Lohse MJ: β1-Adrenergic receptor function, autoimmunity, and pathogenesis of dilated cardiomyopathy. In: Trends Cardiovasc. Med.. 16, Nr. 1, Januar 2006, S. 20–24. doi:10.1016/j.tcm.2005.11.002. PMID 16387626.
- Fitzpatrick, David; Purves, Dale; Augustine, George (2004). "Table 20:2". Neuroscience (Third ed.). Sunderland, Mass: Sinauer. ISBN 0-87893-725-0.
- Frielle T, Collins S, Daniel KW, Caron MG, Lefkowitz RJ, Kobilka BK: Cloning of the cDNA for the human beta 1-adrenergic receptor. In: Proc Natl Acad Sci U S A. 84, Nr. 22, November 1987, S. 7920–7924. PMID 2825170.
- Leineweber K, Heusch G: Beta 1- and beta 2-adrenoceptor polymorphisms and cardiovascular diseases. In: Br J Pharmacol. 158, Nr. 1, September 2009, S. 61–69. doi:10.1111/j.1476-5381.2009.00187.x. PMID 19422376.
- Warne T, Serrano-Vega MJ, Baker JG et al.: Structure of a beta1-adrenergic G-protein-coupled receptor. In: Nature. 454, Nr. 7203, Juli 2008, S. 486–491. doi:10.1038/nature07101. PMID 18594507.
- Huang J, Chen S, Zhang JJ, Huang XY: Crystal structure of oligomeric β1-adrenergic G protein-coupled receptors in ligand-free basal state. In: Nat. Struct. Mol. Biol.. 2013. doi:10.1038/nsmb.2504. PMID 23435379.
- Warne T, Moukhametzianov R, Baker JG et al.: The structural basis for agonist and partial agonist action on a β(1)-adrenergic receptor. In: Nature. 469, Nr. 7329, Januar 2011, S. 241–244. doi:10.1038/nature09746. PMID 21228877.