Thioflavin
Thioflavin T ist ein Benzothiazol-basierter kationischer Farbstoff, der als potenter Marker für Amyloidose in der Histologie eingesetzt wird.[3] Er wird auch eingesetzt um die elektrische Fluktuation in bakteriellen Biofilmen zu untersuchen.[4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
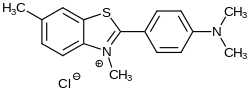 | |||||||||||||||||||
| Thioflavin T | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Thioflavin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C17H19ClN2S | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 318,86 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Herstellung Thioflavin T
Thioflavin T ist das Trimethylchlorid des Dehydrothiotoluidins [6-Methyl-2-(4-aminophenyl)benzothiazol]. Durch Umsetzung von p-Toluidin mit Schwefel bei erhöhter Temperatur ist das Dehydrothiotoluidin zugänglich.[5] Dieses wird durch die Methylierung mit Methanol unter Anwesenheit von Salz- oder Schwefelsäure zum Thioflavin T umgesetzt.[6][7]
Verwendung Thioflavin T
Thioflavin T kann als Farbstoff zum Färben von Seide und tannierter Baumwolle eingesetzt werden.[7]
Der Einsatz von Thioflavin in der Histologie wurde erstmals 1959 von den Pathologen Philip S.Vassar und Charles F. Culling vom Department für Pathologie der Universität Vancouver beschrieben. Hierbei wurde Thioflavin T zur histologischen Untersuchung von Nierentumoren auf Amyloidose eingesetzt.[8] In einem folgenden Bericht 1961 beschrieben sie bei der Untersuchung zweier hemithyreoidektomisch erhaltenen Schilddrüsenkarzinomen. In beiden Proben erzeugte die Behandlung mit Thioflavin T eine leuchtend gelbgrün fluoreszierende Färbung in der Stoma der Tumore mittels ultraviolettem Licht unter einem Fluoreszensmikroskop deutlich zu erkennen.[9]
Bei weiteren Untersuchungen zeigte sich, dass Thioflavin T mit einer Vielzahl von Gewebekomponenten interagiert. Diese erzeugen jeweils spezifische Färbungsmuster. Zu den Gewebearten gehören Mucopolysacaride, Nukleinsäuren und viele Strukturen, welche in Amyloidfibrillen enthalten sind. Besonders bei der Diagnose der Alzheimer-Erkrankung werden diese Eigenschaften genutzt. So wurde die Untersuchung der Fluoreszenzfärbung von senilen, aber nicht diffusen Plaques in den betroffenen Regionen des Alzheimer-Syndroms, sowie die grün-doppelbrechende Congo-Rot-Färbung der gleichen Strukturen wurden als anatomische neuropathologische Kriterien für die Krankheit festgelegt.[10] Die Diagnose von Amyloidfibrillen kann in vivo, ex vivo oder in vitro erfolgen.[11]
Die Struktur von Thioflavin T hat ein hydrophobes Ende mit einer Dimethylaminogruppe, welche sich in Paraposition zu einer polaren Benzothiazolgruppe an einer Phenylgruppe befindet. Durch diese Kombination von polaren und hydrophoben Regionen, bilden die Thioflavin T-Moleküle in wässrigen Lösungen Mizellen mit hydrophoben Innenräumen. Das positiv geladene Stickstoff-Atom zeigt dabei auf das Lösungsmittel. Dadurch bilden sich zwischen den Thioflavin T-Mizellen und den Gewebestrukturen Wasserstoffbrückenbindungen aus.[11]
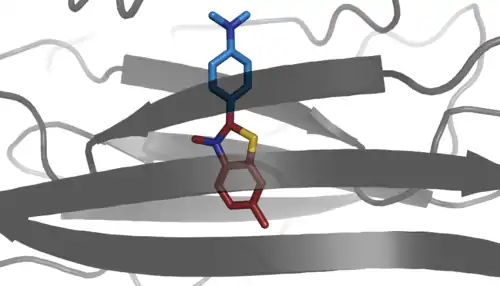
Durch die die Bindung des Thioflavin T an die Amylidosefibrillen findet eine Rotverschiebung des Anregungsspektrums von 336 nm des freien Farbstoffes in wässriger Lösung zu einem Erregungsmaximum von 450 nm des gebundenen Farbstoffes statt. Diese charakteristische hyperchromische[12] Fluoreszenzanregungsverschiebung findet jedoch nur bei Amyloidosen, welche über die multimeren fibrillären Formen der β-Blatt-Polymere verfügen. Nur die β-Blatt-Polymere bieten eine geeignete Umgebung zur Stabilisierung des elektronischen Grundzustandes des Farbstoffes, durch den sich die große Rotverschiebung des Anregungsmaximums ergibt.[10] Eine andere Studie nennt die elektrostatische Wechselwirkung zwischen Doppelsträngiger DNA und Thioflavin T als mögliche Ursache für eine Rotverschiebung in derselben Größenordnung, welche jedoch von der Konzentration der DNA abhängig ist und durch die Anwesenheit von Natriumchlorid eliminiert werden kann.[13]
Die Veränderung des Spektrums des Farbstoffes ergibt sich aus einer Rotationsimmobilisierung der Phenylgruppe. Diese verhält sich in freier Lösung wie ein molekularer Rotor. Demnach konkurriert im freien Molekül ein nicht fluoreszierender TICT-Prozess (twisted intramolecular charge transfer) mit einem fluoreszierenden LE-Zustand (localy excited). Demnach ändert sich der Torsionswinkel durch den TICT-Prozess zwischen der Phenylgruppe und der Benzothiazolgruppe im angeregten Singulettzustand von 37° auf 90°. Dieser Prozess konkurriert effektiv mit dem Strahlungsübergang des LE-Zustandes und löscht die Fluoreszenz dadurch aus. Wenn das Thioflavin T-Molekül jedoch an ein Amyloid gebunden ist, wird diese Rotation unterbunden, wodurch die Löschung des fluoreszierenden LE-Zustandes unterdrückt wird.[14][15]
Thioflavin T erzeugt eine überragend spezifische bzw. charakteristische Fluoreszenz bei Amyloidose, das einzige falsch-positive Ergebnis von Thioflavin T in diesem Spektrum kam bei Polysacchariden in der Aortenwand bei dem Marfan-Syndrom vor.[16]
Genetische Studien mit Fadenwürmern der Art Caenorhabditis elegans haben gezeigt, dass der Einsatz von Thioflavin T die Aggregation von Proteinfibrillen verlangsamen kann. Dies kann zu einer erheblich verlängerten Lebensdauer und einem verlangsamten Alterungsprozess führen. Zudem unterdrückt Thioflavin T auch pathologische Merkmale mutierter metastabiler Proteine und β-amyloid-assoziierte Toxizität beim Menschen. Dies kann zu einer pharmazeutischen Pflege des Protein-Homöostase-Netzwerks führen, welches eine tiefgreifende Wirkung auf die Alterung und auf altersbedingte Krankheiten haben kann.
Thioflavin S
Thioflavin S erhält man durch Sulfierung bei der Methylierung der Purinbase mit Schwefelsäure.[7] Es ist ein komplexes Gemischung von Verbindungen, deren Strukturen nicht charakterisiert wurden.[17][18]
Da sich bei der Bindung von Thiofalvin S an die Amyloidfibrillen zwar die Emissionsintensität um ein Vielfaches erhöht, ohne dass sich jedoch die Anregungs- und Emissionsspektren ändern, führt dies zu einer hohen Hintergrundfluoreszenz. Dadurch ist dieser Farbstoff nicht für quantitative Analysen in Lösung geeignet.[18]
Die Bindungsart von Thioflavon S an die Amyloidose entspricht dabei wahrscheinlich derselben wie der von Kongorot.[19]
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 2-[4-(dimethylamino)phenyl]-3,6-dimethylbenzothiazolium chloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 5. Januar 2019.
- Biosynth Direct Store: Thioflavin T – CAS: 2390-54-7 – Basic Yellow 1 – Alle Produkte – Biosynth Direct Store, abgerufen am 15. Januar 2019.
- Molecular mechanism of Thioflavin-T binding to amyloid fibrils. In: Biochimica et Biophysica Acta (BBA) – Proteins and Proteomics. Band 1804, Nr. 7, 1. Juli 2010, ISSN 1570-9639, S. 1405–1412, doi:10.1016/j.bbapap.2010.04.001, PMID 20399286, PMC 2880406 (freier Volltext).
- Gürol M. Süel, Jordi Garcia-Ojalvo, San Ly, Munehiro Asally, Jintao Liu: Ion channels enable electrical communication in bacterial communities. In: Nature. Band 527, Nr. 7576, November 2015, ISSN 1476-4687, S. 59–63, doi:10.1038/nature15709, PMID 26503040, PMC 4890463 (freier Volltext).
- Rudolf Nietzki: Chemie der organischen Farbstoffe. 5. Auflage, Julius Springer, Berlin 1906, S. 289 (Digitalisat).
- Basic Yellow 1. http://www.worlddyevariety.com, abgerufen am 2. Januar 2019.
- Klaus Hunger (Hrsg.): Industrial Dyes: Chemistry, Properties, Applications. WILEY-VCH Verlag, Weinheim 2003, ISBN 978-3-662-01950-4, S. 261 (eingeschränkte Vorschau in der Google-Buchsuche).
- Matthew Biancalana, Shohei Koide: Molecular mechanism of Thioflavin-T binding to amyloid fibrils. In: Biochimica et Biophysica Acta (BBA) – Proteins and Proteomics. Band 1804, Nr. 7, Juli 2010, ISSN 1570-9639, S. 1405–1412, doi:10.1016/j.bbapap.2010.04.001.
- Philip S. Vassar, Charles F. Culling: The Significance of Amyloid in Carcinoma of the Thyroid Gland. In: American Journal of Clinical Pathology. Band 36, Nr. 3, 1. September 1961, ISSN 0002-9173, S. 244–247, doi:10.1093/ajcp/36.3.244.
- Harry LeVine: Thioflavine T interaction with amyloid β-sheet structures. In: Amyloid. Band 2, Nr. 1, Januar 1995, ISSN 1350-6129, S. 1–6, doi:10.3109/13506129509031881.
- Mechanism of thioflavin T binding to amyloid fibrils. In: Journal of Structural Biology. Band 151, Nr. 3, 1. September 2005, ISSN 1047-8477, S. 229–238, doi:10.1016/j.jsb.2005.06.006.
- Hyperchromie. In: Lexikon der Physik. Spektrum.de-Logo, abgerufen am 28. Februar 2019.
- Emission of thioflavin T and its control in the presence of DNA. In: Journal of Photochemistry and Photobiology A: Chemistry. Band 162, Nr. 1, 20. Februar 2004, ISSN 1010-6030, S. 129–137, doi:10.1016/S1010-6030(03)00320-4.
- Vitali I. Stsiapura, Alexander A. Maskevich, Valery A. Kuzmitsky, Konstantin K. Turoverov, Irina M. Kuznetsova: Computational Study of Thioflavin T Torsional Relaxation in the Excited State. In: The Journal of Physical Chemistry A. Band 111, Nr. 22, Juni 2007, ISSN 1089-5639, S. 4829–4835, doi:10.1021/jp070590o.
- E. S. Voropai, M. P. Samtsov, K. N. Kaplevskii, A. A. Maskevich, V. I. Stepuro: Spectral Properties of Thioflavin T and Its Complexes with Amyloid Fibrils. In: Journal of Applied Spectroscopy. Band 70, Nr. 6, November 2003, ISSN 0021-9037, S. 868–874, doi:10.1023/b:japs.0000016303.37573.7e.
- S. M. Saeed, Gerald Fine: Thioflavin-T for Amyloid Detection. In: American Journal of Clinical Pathology. Band 47, Nr. 5, 1. Mai 1967, ISSN 0002-9173, S. 588–593, doi:10.1093/ajcp/47.5.588.
- GABRIEL KELIÉNYI: ON THE HISTOCHEMISTRY OF AZO GROUP-FREE THIAZOLE DYES. In: Journal of Histochemistry & Cytochemistry. Band 15, Nr. 3, März 1967, ISSN 0022-1554, S. 172–180, doi:10.1177/15.3.172.
- Harry LeVine: [18] Quantification of β-sheet amyloid fibril structures with thioflavin T. In: Methods in Enzymology. Elsevier, 1999, ISBN 978-0-12-182210-1, S. 274–284, doi:10.1016/s0076-6879(99)09020-5.
- Harry Levine: Thioflavine T interaction with synthetic Alzheimer's disease β-amyloid peptides: Detection of amyloid aggregation in solution. In: Protein Science. Band 2, Nr. 3, 31. Dezember 2008, ISSN 0961-8368, S. 404–410, doi:10.1002/pro.5560020312.


