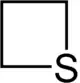
Thietan
Thietan, auch Trimethylensulfid genannt, ist der einfachste schwefelhaltige gesättigte viergliedrige Heterocyclus.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thietan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H6S | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 74,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,028 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
94 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
löslich in Ethanol, Benzol[2] | |||||||||||||||
| Brechungsindex |
1,510 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
24,7 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung
Thietan kann in sehr schlechter Ausbeute aus der Reaktion zwischen 1,3-Dioxan-2-on und Kaliumthiocyanat gewonnen werden. Als Nebenprodukte entstehen Kaliumcyanat und Kohlenstoffdioxid.[5]
Ein besserer Syntheseweg ist durch die Reaktion zwischen 1,3-Dibrompropan und Natriumsulfid gegeben.[6]
Eigenschaften
Thietan ist eine farblose, unangenehm riechende Flüssigkeit[2], die unter Normaldruck bei 94,8 °C siedet.[7] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,14157, B = 1321,331 und C = −48.637 im Temperaturbereich von 321,5 bis 404,8 K.[8] In fester Phase werden zwei polymorphe Kristallformen gebildet, wo sich bei −96 °C die Kristallform II in die Kristallform I umwandelt.[9] Der Schmelzpunkt liegt dann bei −73 °C.[9] Das Molekül ist nicht perfekt quadratisch gebaut, sondern besitzt eine verzerrte Struktur. Der Bindungswinkel am Schwefel beträgt 78°, während der gegenüberliegende Kohlenstoff einen Bindungswinkel von 97° aufweist. Die C-S-Bindungslänge beträgt 185,1 pm, die C–C-Bindungslänge 154,9 pm.[10]
Reaktionen
Mit Nukleophilen reagiert Thietan unter Ringöffnung. So bildet sich beispielsweise aus der Umsetzung mit n-BuLi ein unsymmetrischer Thioether.[11]
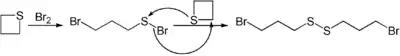
Die Umsetzung mit elementaren Halogenen ermöglicht die Darstellung an beiden Kettenenden halogenierter offenkettiger Disulfide.[12]
Einzelnachweise
- Datenblatt Trimethylene sulfide bei Sigma-Aldrich, abgerufen am 24. April 2011 (PDF).
- Eintrag zu Thietane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- D. W. Scott, H. L. Finke, W. N. Hubbard, J. P. McCullough, C. Katz, M. E. Gross, J. F. Messerly, R. E. Pennington, G. Waddington in: J. Am. Chem. Soc. 1953, 75, 2795–2800. doi:10.1021/ja01108a001
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- S. Searles, E. F. Lutz in: A new synthesis of small ring cyclic sulfides J. Am. Chem. Soc. 1958, 80, 3168. doi:10.1021/ja01545a071
- K. Nagasawa, A. Yoneta: Chemistry. II. Use of Dimethyl Sulfoxide – a Facile Synthesis of Cyclic Sulfides in Chem. Pharm. Bull. 1985, 33, 5048–5052, doi:10.1248/cpb.33.5048, pdf.
- CRC Handbook of Data on Organic Compounds, 2nd Edition, Weast,R.C and Grasselli, J.G., ed(s)., CRC Press, Inc., Boca Raton, FL, 1989, 1.
- Osborn, A.G.; Douslin, D.R.: Vapor Pressure Relations of 36 Sulfur Compounds Present in Petroleum in J. Chem. Eng. Data, 1966, 11, 4, 502–509, doi:10.1021/je60031a014.
- Scott, D.W.; Finke, H.L.; Hubbard, W.N.; McCullough, J.P.; Katz, C.; Gross, M.E.; Messerly, J.F.; Pennington, R.E.; Waddington, G.: Thiacyclobutane: heat capacity, heats of transition, fusion and vaporization, vapor pressure, entropy, heat of formation and thermodynamic functions in J. Am. Chem. Soc., 1953, 75, 2795–2800, doi:10.1021/ja01108a001.
- Goldish in: J. Chem. Educ. 1959, 36, 408–411. ISSN 0021-9584
- F. G. Bordwell, H. M. Andersen, M. P. Burnett: The reaction of thiacyclopropanes and thiacyclobutanes with organolithium compounds, in: J. Am. Chem. Soc., 1954, 76, 1082–1085; doi:10.1021/ja01633a045.
- J. M. Stewart, C. H. Burnside: Reactions of trimethylenesulfide with chlorine and bromine, in: J. Am. Chem. Soc., 1953, 75, 243–244; doi:10.1021/ja01097a517.

