Tetraphenylmethan
Tetraphenylmethan wurde in den Jahren 1896/1897 vom Chemiker Moses Gomberg zusammen mit Adolf von Baeyer, Johannes Thiele und Victor Meyer erstmals synthetisiert. Von Tetraphenylmethan abgeleitete Verbindungen dienen heute als Material für OLEDs.[4]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
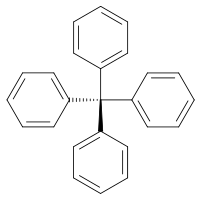 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetraphenylmethan | |||||||||||||||
| Andere Namen |
1,1,1,1-Methantetrayltetrakisbenzol | |||||||||||||||
| Summenformel | C25H20 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 320,42 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,217 g·cm−1[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
431 °C[2] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Strukturell ähnliche Verbindungen sind z. B. Triphenylmethan und Natriumtetraphenylborat.
Darstellung und Gewinnung
Die Synthese von Tetraphenylmethan erfolgt in einer dreistufigen Synthese. Im ersten Schritt erfolgt eine Friedel-Crafts-Alkylierung von Aniliniumchlorid mit Triphenylmethanol. Danach wird das Zwischenprodukt diazotiert. Die Zielverbindung ergibt sich dann durch eine Reduktion mit Phosphinsäure.[2]
Eigenschaften
Tetraphenylmethan bildet farblose Kristalle, die bei 285 °C mit einer Schmelzwärme von 48,28 kJ·mol−1 schmelzen.[5][2] Die Verbindung neigt schon bei Temperaturen ab 90 °C zur Sublimation.[5] Die Dampfdruckfunktion ergibt sich nach August entsprechend ln(P) = A+B/T (P in Pa, T in K) mit A = 38,02 und B = −16280 im Temperaturbereich von 90 °C bis 115 °C.[5] Die Sublimationswärme beträgt 135,4 kJ·mol−1.[5] Die Verbindung liegt in einem tetragonalen Kristallgitter vor.[6]
Weblinks
Literatur
- M. Gomberg, Oliver Kamm: Tetraphenylmethane, in: J. Am. Chem. Soc., 1917, 39 (9), S. 2009–2015 (doi:10.1021/ja02254a016).
- Hsiu-Chih Yeh, Rong-Ho Lee, Li-Hsin Chan, Tzu-Yao Jeremy Lin, Chin-Ti Chen, Easwaramoorthy Balasubramaniam, Yu-Tai Tao: Synthesis, Properties, and Applications of Tetraphenylmethane-Based Molecular Materials for Light-Emitting Devices, in: Chem. Mater., 2001, 13 (9), S. 2788–2796 (doi:10.1021/cm0008056).
- Kacey Claborn, Bart Kahra, Werner Kaminsky: Calculations of optical properties of the tetraphenyl-X family of isomorphous crystals (X = C, Si, Ge, Sn, Pb). In: CrystEngComm. Band 4, Nr. 46, 2002, doi:10.1039/B202304K (PDF).
Einzelnachweise
- Datenblatt Tetraphenylmethan bei Acros, abgerufen am 19. Februar 2010.
- Eintrag zu Tetraphenylmethan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. November 2016.
- Datenblatt Tetraphenylmethane, 96% bei AlfaAesar, abgerufen am 1. November 2016 (PDF) (JavaScript erforderlich).
- Patent US7052783: Oxadiazole tetramers. Veröffentlicht am 1. August 2002, Erfinder: LEE RONG-HO, CHEN CHIN-TI, YEH HSIU-CHIH, CHAN LI-HSIN.
- Verevkin, S.P.: Thermochemical Properties of Triphenylalkanes and Tetraphenylmethane. Strain in Phenyl Substituted Alkanes in J. Chem. Eng. Data 44 (1999) 557–562, doi:10.1021/je9802726.
- Osvald Knop, Kathryn N. Rankin, T. Stanley Cameron, Russell J. Boyd: Crystal chemistry of tetraradial species. Part 10. Tilting at windmills: conformations of the tetraphenyl species ZPh40, ±1 (Z = B, C, N). In: Canadian Journal of Chemistry. Band 80, Nr. 10, 2002, S. 1351–1366, doi:10.1139/v02-171.