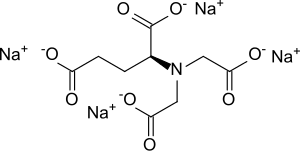
Tetranatrium-N,N-bis(carboxylatomethyl)-L-glutamat
Tetranatrium-N,N-bis(carboxylatomethyl)-L-glutamat (GLDA-Na4) ist das Tetranatriumsalz der L-Glutaminsäure-N,N-diessigsäure (GLDA-H4), das von der Aminosäure Glutaminsäure abgeleitet ist und sich als Komplexbildner vom Aminopolycarboxylat-Typ durch besonders hohe Bioabbaubarkeit und Löslichkeit auszeichnet.[4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tetranatrium-N,N-bis(carboxylatomethyl)-L-glutamat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C9H9NO8Na4 | ||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 351,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
GLDA-Na4 wird als „grüne“ Alternative zu den am meisten verbreiteten Chelatoren Ethylendiamintetraessigsäure (EDTA) und Nitrilotriessigsäure (NTA) diskutiert.
Gewinnung und Darstellung
Ausgangsstoff für GLDA-Na4 ist L-Glutaminsäure[5] und besonders das wesentlich besser wasserlösliche und als Geschmacksverstärker in Mengen über 3 Millionen Tonnen pro Jahr hergestellte Mononatriumglutamat (MSG).[6] Zur Erzielung akzeptabler Ausbeuten wird MSG bei pH<7 in einer Cyanmethylierung mit wässrigem Formaldehyd und Cyanwasserstoff zu Natriumglutamat-diacetonitril, einem substituierten Iminodiacetonitril, umgesetzt.[7]
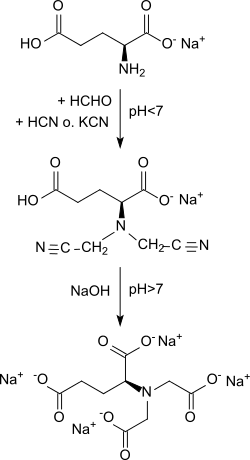
Das Diacetonitril wird mit Natronlauge unter Abspaltung von Ammoniak in über 90 %iger Ausbeute zum Tetranatriumsalz der L-Glutaminsäure-N,N-diessigsäure hydrolysiert.[8]
Eine Verfahrensvereinfachung stellt die Verwendung von Natriumcyanid anstatt Blausäure dar.[9] Die erhaltenen Ausbeuten liegen bei 90 % mit Gehalten am Nebenprodukt Nitrilotriessigsäure von deutlich unter 0,1 Gew.-%. Die Reaktion kann sowohl diskontinuierlich als Chargenprozess, als auch als kontinuierlicher Prozess ausgeführt werden.
Eigenschaften
Tetranatrium-N,N-bis(carboxylatomethyl)-L-glutamat ist ein weißer, sehr gut wasserlöslicher, hygroskopischer Feststoff, der alkalisch reagierende (typischerweise pH 11,5) und schwach gelbe wässrige Lösungen bildet.[4] Im Gegensatz zu EDTA und NTA löst sich GLDA-Na4 in wässrigen Medien sehr gut über einen breiten pH-Bereich von 1 bis 12. Die thermische Stabilität (Zersetzung >280 °C) liegt deutlich über der von EDTA und NTA (>150 °C).[10]
Verwendung
Wegen der (derzeit) akzeptierten, aber letztlich unbefriedigenden ökologischen und toxikologischen Profile der gängigsten und auf petrochemischen Rohstoffen basierenden Komplexbildner EDTA und NTA wird weiter nach umweltverträglicheren Alternativen gesucht. Neben β-Alanindiessigsäure (β-ADA), Methylglycindiessigsäure (MGDA), Tetranatriumiminodisuccinat (IDHA) sowie Citraten und Gluconaten wurde Tetranatrium-N,N-bis(carboxylatomethyl)-L-glutamat als bioabbaubarer und weitgehend aus nachwachsenden Rohstoffen – hier L-Glutaminsäure – hergestellter Komplexbildner entwickelt. GLDA-Na4 ist nach der OECD-Methode OECD 301 D (>60 % nach 28 Tagen) als leicht biologisch abbaubar klassifiziert.[10]
Die folgende Tabelle gibt die Komplexbildungskonstanten log K von GLDA im Vergleich zu den Standards EDTA und NTA, sowie zu den bioabbaubaren Komplexbildnern Methylglycindiessigsäure (MGDA) und Tetranatriumiminodisuccinat (IDS) gegenüber mehrwertigen Metallionen wieder:
| Metallionen | GLDA[11] | EDTA | NTA[11] | MGDA[12] | IDS[13] |
|---|---|---|---|---|---|
| Al3+ | 12,2 | 16,4 | 11,4 | - | 14,1 |
| Ba2+ | 3,5 | 7,9 | 4,8 | 4,9 | 3,4 |
| Ca2+ | 5,9 | 10,7 | 6,4 | 7,0 | 5,2 |
| Cd2+ | 9,1 | 16,5 | 9,8 | 10,6 | 8,4 |
| Co2+ | 10,0 | 16,5 | 10,4 | 11,1 | 10,5 |
| Cu2+ | 13,1 | 18,8 | 13,0 | 13,9 | 13,1 |
| Fe2+ | 8,7 | 14,3 | 8,9 | 8,1 | 8,2 |
| Fe3+ | 11,7 | 25,1 | 15,9 | 16,5 | 15,2 |
| Hg2+ | 14,3 | 21,5 | 14,3 | - | 14,9 |
| Mg2+ | 5,2 | 8,8 | 5,5 | 5,8 | 6,1 |
| Mn2+ | 7,6 | 13,9 | 7,5 | 8,4 | 7,7 |
| Ni2+ | 10,9 | 18,4 | 11,5 | 12,0 | 12,2 |
| Pb2+ | 10,5 | 18,0 | 11,5 | 12,1 | 11,0 |
| Sr2+ | 4,1 | 8,7 | 5,0 | 5,2 | 4,1 |
| Zn2+ | 10,0 | 16,5 | 10,7 | 10,9 | 10,8 |
EDTA weist gegenüber allen Kationen im Vergleich zu anderen Chelatoren deutlich höhere Komplexbildungskonstanten auf und bildet daher auch stabilere Komplexe als GLDA, das meist geringfügig niedrigere log K-Werte mit Metallionen als NTA besitzt.
Die wichtigste Eigenschaft von Chelatoren ist die Komplexbildung mit Calcium- und Magnesium-Ionen als wesentliche Verursacher für Wasserhärte. Chelatisierung der härtebildenden Ca2+-Ionen mit GLDA-Na4 kann die Ausfällung von Calciumcarbonat, auch bei hohen Temperaturen, verhindern und die Auflösung von Kalkablagerungen fördern. Dadurch wirkt Tetranatrium-N,N-bis(carboxylatomethyl)-L-glutamat als so genannter Builder in Wasch- und Reinigungsmitteln, indem es die Emulgatorwirkung von Tensiden verbessert.[5]
Wegen seiner sehr guten Wasserlöslichkeit und Stabilität auch bei hohen pH-Werten eignet sich GLDA-Na4 zum Ersatz von Natriumtripolyphosphat (engl. STPP) in maschinellen Geschirrspülmitteln oder phosphatfreien Waschmitteln.[14]
GLDA-Na4 erhöht die Wirksamkeit von Bioziden durch Komplexierung von Ca2+- und Mg2+-Ionen, die zur Destabilisierung der Membranen von Mikroorganismen führt und so deren Empfindlichkeit gegenüber Konservierungsmitteln und Bioziden erhöht.
Die komplexbildenden Eigenschaften von GLDA-Na4 werden in der Öl- und Gasförderung zur Auflösung von Ablagerungen von Strontiumsulfat, Bariumsulfat und Calciumsulfat und zur Verhinderung der Ausfällung schwerlöslicher Eisensalze eingesetzt.[15]
Komplexe von Spurenelementen mit Tetranatrium-N,N-bis(carboxylatomethyl)-L-glutamat finden als Mikronährstoffe (engl. micronutrients) in Düngemitteln[16] und als Lebensmittel- und Futterzusätze (Supplement) Verwendung.[17]
Einzelnachweise
- Eintrag zu TETRASODIUM GLUTAMATE DIACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 29. Dezember 2019.
- Eintrag zu Tetranatrium-N,N-bis(carboxylatomethyl)-L-glutamat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. April 2016. (JavaScript erforderlich)
- Green chelating agent. In: Chemical Engineering. 1. Februar 2007, abgerufen am 28. April 2016.
- Dissolvine® GL technical brochure. (PDF; 5,8 MB) (Nicht mehr online verfügbar.) In: akzonobel.com. Akzo Nobel Functional Chemicals, archiviert vom Original am 26. April 2016; abgerufen am 28. April 2016 (englisch).
- Patent US5948748: Detergent composition. Angemeldet am 2. Oktober 1997, veröffentlicht am 7. September 1999, Anmelder: Kao Corp., Erfinder: G. Hagino, S. Tagata, S. Kamioka.
- Glutamic Acid and Monosodium Glutamate (MSG) Market Size, Potential, Industry Outlook, Regional Analysis, Application Development, Competitive Landscape & Forecast, 2016 - 2023. In: Global Market Insights. Abgerufen am 28. April 2016.
- Patent WO2009109544A1: Verfahren zur Herstellung von Aminodicarbonsäure-N,N-diessigsäuren. Angemeldet am 2. März 2009, veröffentlicht am 11. September 2009, Anmelder: BASF SE, Erfinder: A. Oftring, A. Stamm, F. Wirsing, G. Braun.
- Patent US8399705: Alkali metal salt of glutamic acid N,N-diacetic acid, a process to prepare such salt, and the use thereof. Angemeldet am 14. August 2008, veröffentlicht am 19. März 2013, Anmelder: Akzo Nobel N.V., Erfinder: T.O. Boonstra, M. Heus.
- Patent WO2010139755A1: Process to prepare a chelating agent or precursor thereof using a cyanide salt. Angemeldet am 3. Juni 2010, veröffentlicht am 9. Dezember 2010, Anmelder: Akzo Nobel Chemicals International B.V., Erfinder: H. Lammers, M. Heus, T.O. Boonstra, A.M. Reichwein.
- J. Seetz, G.P. Stafford: Bound by biodegradability. In: Soap, Perfumery & Cosmetics. 2007, S. 75–76 (PDF; 1,6 MB).
- Chelates Product Guide. (PDF; 4,9 MB) (Nicht mehr online verfügbar.) In: akzonobel.com. Akzo Nobel Functional Chemicals, archiviert vom Original am 26. April 2016; abgerufen am 28. April 2016 (englisch).
- BASF SE, Technical Information, Trilon® M types: Trilon M types
- Lanxess AG, General Product Information: Baypure
- Patent US20160097020A1: Aqueous solutions containing a complexing agent in high concentration. Angemeldet am 13. Mai 2014, veröffentlicht am 7. April 2016, Anmelder: BASF SE, Erfinder: M.C. Biel, T. Greindl, M. Hartmann, W. Staffel, M. Reinoso Garcia.
- Patent WO2012146895A1: Treatment fluids containing biodegradable chelating agents and methods for use thereof. Angemeldet am 26. April 2012, veröffentlicht am 1. November 2012, Anmelder: Halliburton Energy Services, Inc., Erfinder: E.A. Reyes, T.D. Welton.
- Patent WO2015036374A2: Acidic fertilizer compositions containing a metal complex of glutamic acid N,N′-diacetic acid or iminosuccinic acid. Angemeldet am 9. September 2014, veröffentlicht am 19. März 2015, Anmelder: Akzo Nobel Chemicals International B.V., Erfinder: A.M. Reichwein, M.H.J. Bugter.
- Patent WO2011051295A1: Use of a metal supplement in animal feed. Angemeldet am 26. Oktober 2010, veröffentlicht am 5. Mai 2011, Anmelder: Akzo Nobel Chemicals International B.V., Erfinder: C.T.J. Wreesmann, A.M. Reichwein, M.A. van Doorn, J. Martintereso López.