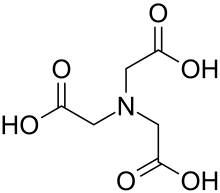
Nitrilotriessigsäure
Nitrilotriessigsäure oder kurz NTA ist ein Komplexbildner. In wässriger Lösung bildet NTA stabile Komplexverbindungen mit Metallionen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Nitrilotriessigsäure (NTA) | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H9NO6 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 191,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
schwer in Wasser (1,28 g·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Verwendung
NTA wird teilweise zur Wasserenthärtung eingesetzt. Die Verwendung als enthärtender Zusatz in Waschmitteln ist trotz der biologischen Abbaubarkeit von NTA in Kläranlagen in den letzten Jahren zurückgegangen, da man das Lösungsvermögen von Schwermetallen als problematisch ansieht. In der analytischen Chemie ist es bekannt als Komplexon I und wird in der Komplexometrie zur Bestimmung von Metallionen benutzt. Im Jahr 1999 wurden in Europa 20.000 Tonnen NTA verbraucht.
Verwendung in der Forschung
Ferner wird es in der Affinitätschromatografie als Chelatligand (meist mit Ni2+ als Zentralion) zur Reinigung von poly-Histidin-getaggten Proteinen eingesetzt. Der Aufreinigungseffekt kommt dadurch zustande, dass das Polyhistidin an das Metal der Metall-Chelator-Komplexe bindet. Als Metalle eignen sich beispielsweise Nickel, Kupfer oder Zink. Früher wurde vor allem Iminodiessigsäure (IDA) als Chelator verwendet. Dieser wurde allerdings im Laufe der Zeit von NTA abgelöst.[4] Für die biologische Forschung koppelte Ernst Hochuli 1987 den NTA-Liganden an Agarose Kügelchen.[5] Diese Ni-NTA Agarose[6] ist das mit Abstand am häufigsten verwendete Werkzeug um His-Tag Proteine via Affinitätschromatografie aufzureinigen.
Biologische Bedeutung
Es wurde vermutet, dass NTA in Gewässern Schwermetalle aus dem Sediment mobilisieren kann. In der Praxis ist dies nicht der Fall, da NTA in natürlichen Gewässern als stabiler Calciumkomplex vorliegt. Es besteht der Verdacht, dass dieser Stoff krebserzeugend wirkt.
Nachweis
NTA kann mit Kupfersulfatlösung und Komplexindikator nachgewiesen werden.
Einzelnachweise
- Eintrag zu Nitrilotriessigsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. April 2014.
- Eintrag zu Nitrilotriessigsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Eintrag zu Nitrilotriacetic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Sabine A. Lauer, John P. Nolan: Development and characterization of Ni-NTA-bearing microspheres. In: Cytometry. Band 48, Nr. 3, 2002, ISSN 1097-0320, S. 136–145, doi:10.1002/cyto.10124.
- E. Hochuli, H. Döbeli, A. Schacher: New metal chelate adsorbent selective for proteins and peptides containing neighbouring histidine residues. In: Journal of Chromatography A. Band 411, 1987, S. 177–184, doi:10.1016/S0021-9673(00)93969-4.
- Ni-NTA Agarose

