Selentetrachlorid
Selentetrachlorid ist eine anorganische chemische Verbindung des Selens aus der Gruppe der Chloride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Se4+ _ Cl− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Selentetrachlorid | |||||||||||||||
| Andere Namen |
Selen(IV)-chlorid | |||||||||||||||
| Verhältnisformel | SeCl4 | |||||||||||||||
| Kurzbeschreibung |
gelblicher Feststoff mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 220,77 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
2,6 g·cm−3 (25 °C)[2] | |||||||||||||||
| Schmelzpunkt |
305 °C (unter Druck)[3] | |||||||||||||||
| Sublimationspunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,807 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Selentetrachlorid kann durch Reaktion von Selen mit Chlor gewonnen werden.[3]
Eigenschaften
Selentetrachlorid ist ein farbloser[6] bis gelblicher feuchtigkeitsempfindlicher Feststoff mit stechendem Geruch, der sich mit Wasser und an feuchter Luft zu Seleniger Säure und Salzsäure zersetzt.[1][7]
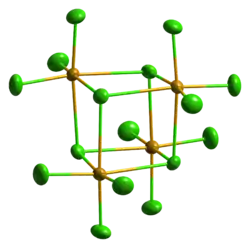
Beim Erhitzen sublimiert Selentetrachlorid.[1] Im geschlossenen Rohr schmilzt es bei etwa 305 °C zu einer dunkelroten Flüssigkeit.[3] Es kristallisiert kubisch in der Raumgruppe P43n (Raumgruppen-Nr. 218) mit dem Gitterparameter a = 16,433 Å.[8] Auch eine metastabile, monokline Struktur ist bekannt (Raumgruppe C2/c (Nr. 15), a = 16,548, b = 9,81, c = 15,029 Å, β = 116,95°).[9] In konzentrierter Salzsäure bildet SeCl4 mit Alkalichloriden Hexachloroselenate(IV), wie z. B. das gelbe Caesiumhexachloroselenat(IV) Cs2[SeCl6].[10]
Einzelnachweise
- Datenblatt Selenium(IV) chloride bei AlfaAesar, abgerufen am 24. November 2013 (PDF) (JavaScript erforderlich).
- Datenblatt Selenium tetrachloride bei Sigma-Aldrich, abgerufen am 25. Mai 2017 (PDF).
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 417.
- Henry G. Nowak and John F. Suttle: Selenium(IV) chloride. In: Therald Moeller (Hrsg.): Inorganic Syntheses. Band 5. McGraw-Hill, Inc., 1957, S. 125–127 (englisch).
- Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 720 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 621.
- Wilhelm Ostwald: Grundlinien der anorganischen Chemie. BoD – Books on Demand, 1922, ISBN 3-86195-686-1, S. 351 (eingeschränkte Vorschau in der Google-Buchsuche).
- R. Kniep, L. Korte, D. Mootz: Crystal structure of the stable modification of SeCl4. In: Zeitschrift für Naturforschung, Teil B, 36, 1981, S. 1660–1662, doi:10.1515/znb-1981-1231.
- P. Born, D. Mootz, R. Kniep, M. Hein, B. Krebs: Phase relations in the system Se-SeCl4 and the crystal structure of a metastable modification of SeCl4. In: Zeitschrift für Naturforschung, Teil B, 36, 1981, S. 1516–1519, doi:10.1515/znb-1981-1206.
- Synthetic Methods of Organometallic and Inorganic Chemistry, Volume 4, 1997: Volume 4: Sulfur, Selenium and Tellurium, W. A. Herrmann und Christian Erich Zybill, Georg Thieme Verlag, 2014, ISBN 3131794410


