Rußbussard
Der Rußbussard (Buteo albonotatus), früher als Mohrenbussard bezeichnet, ist ein mittelgroßer, schlanker Greifvogel aus der Gattung Buteo innerhalb der Unterfamilie der Bussardartigen (Buteoninae). Die fast gänzlich schwarze Art kommt in zwei voneinander getrennten Gebieten in den südlichen USA und Nordmexiko, beziehungsweise Südmexiko, Mittelamerika sowie großen Teilen Südamerikas rund um das Amazonasbecken vor. Die Anden werden nach Westen hin nur an wenigen Stellen überschritten. Die Geschlechter sind weitgehend gleich gefärbt, Weibchen sind jedoch merklich größer und wesentlich schwerer als Männchen.[1]
| Rußbussard | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Immaturer Rußbussard | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Buteo albonotatus | ||||||||||||
| Kaup, 1847 |
Die im nördlichen Teil des Verbreitungsgebietes brütenden Rußbussarde (südwärts bis Panama) scheinen weitgehend Zugvögel zu sein, die Vögel der übrigen Regionen sind überwiegend Standvögel.[1][2] Die Art mischt sich häufig unter kreisende Truthahngeier, die zwar etwas größer sind, deren Flugsilhuette jedoch der eines Rußbussards weitgehend gleicht. Ob Mimikry vorliegt, ist umstritten.[3]
Der Rußbussard ist sehr anpassungsfähig und findet in unterschiedlichen Landschaftstypen und Klimabereichen geeignete Bruthabitate; er ist eine Art sowohl der heißen Tiefländer und der Küstenebenen, als auch der gemäßigteren Höhenlagen bis 1500 Meter über NHN; es wurden aber auch Brutplätze in Höhen bis zu 3000 Meter bekannt. Er ernährt sich hauptsächlich von kleinen Säugetieren, Vögeln und Reptilien, die er meist in einem langsamen, bodennahen Suchflug aufspürt und am Boden oder in der Luft schlägt.[1]
B. albonotatus wurde 1847 von Johann Jakob Kaup anhand eines aus Mexiko stammenden Balges unter diesem Namen erstbeschrieben. Das Artepitheton ist eine Zusammensetzung aus lat. albus (weiß) und notatus (gezeichnet) und bezieht sich auf den weiß gebänderten, schwarzen Schwanz. Die Art ist trotz ihres großen und zum Teil disjunkten Verbreitungsgebietes monotypisch.[4] IUCN und BirdLife sehen mit Stand Ende 2019 keine ernst zu nehmende Bedrohung; entsprechend bewerten sie die aktuelle Bestandssituation mit LC (least concern) und den Populationstrend aufgrund der großen Anpassungsfähigkeit der Art mit increasing – (zunehmend).[5][6]
Die Art ist in Hinblick auf ihre Biologie, Verbreitung und Populationsdynamik noch unzureichend erforscht. Die Mehrzahl der wissenschaftlichen Informationen betrifft das kleine Verbreitungsgebiet in den südlichen Vereinigten Staaten.
Aussehen
Der Rußbussard ist ein mittelgroßer bis großer, schlanker Bussard mit langen, für einen Bussard schmalen Flügeln, langen Beinen und einem verhältnismäßig langen Schwanz. Die Spitzen der Handschwingen schließen beim sitzenden Vogel in etwa mit der Schwanzspitze ab. Der Färbungsdimorphismus beschränkt sich auf die Bänderung des Schwanzes: Männchen zeigen zwei Bänder, Weibchen noch ein sehr schmales drittes. Der Gewichtsdimorphismus ist beträchtlich: Weibchen sind bis 11 % größer und bis zu 26 % schwerer als Männchen, eine Differenz, die insgesamt in einem massigeren Habitus der Weibchen auch feldornithologisch auswertbar ist. Das Jugendgefieder ist dem Erwachsenengefieder sehr ähnlich. Das durchschnittliche Körpergewicht der Männchen beträgt 637 Gramm, das der Weibchen 891 Gramm. Die Gesamtkörperlänge liegt zwischen 46 und 56 Zentimetern. Große Weibchen haben eine Spannweite von bis zu 140 Zentimetern.[6][1]
_(5271394938).jpg.webp)


Rußbussarde verbringen viel Zeit im Flug. Ihr Jagdflug ist ein weihenartiger langsamer Suchflug mit häufigen Richtungsänderungen und Stopps. Beim Segeln sind die Schwingen meist weit gespreizt und die äußeren Handschwingen tief gefingert; die Flügel werden waagrecht oder in V-Stellung gehalten. In dieser Position sind Rußbussarde nur schwer von Truthahngeiern zu unterscheiden; außer diesen kommen andere dunkelmorphige Bussarde, der in weiten Regionen sympatrische Krabbenbussard, eventuell auch der deutlich größere Tryrannenadler als Verwechslungspartner in Frage.[2][1]
Erwachsenengefieder
Der sitzende Rußbussard ist weitgehend schwarz (oft mit einem leichten Braunton), nur gelegentlich scheinen am Nacken einige weiße Federbasen durch. Die Stirn ist immer weiß, manchmal mit ein paar schwarzen Strähnen durchsetzt. Dieses Merkmal ist auch beim fliegenden Vogel meist erkennbar. Die ungefiederte Zügelregion ist blassgrau. Der relativ lange, schwarze Schwanz ist auf der Oberseite zweimal, eher unauffällig mittelgrau gebändert und grau gerandet. Das Subterminalband ist etwas breiter als das zweite, der Schwanzbasis nähere Band. Die Innenfahnen der meisten Handschwingen sind hellgrau, wodurch bei stark gespreizten Federn in diesem Flügelbereich auch auf der Oberseite hellere Farbelemente erkennbar werden. Auch auf der Unterseite sind das Körpergefieder und die Unterflügeldecken schwarz oder braunschwarz. Die Schwingen, der für einen Bussard schmalen, tief gefingerten Flügel sind silberfarben und dicht und schmal dunkel gebändert. Die beiden Farbelemente kontrastieren scharf und ergeben das typische zweizonale Flugbild. Der Schwanz ist auf der Unterseite deutlich weiß gebändert. Zwei Bänder sind vollständig durchgezogen, bei Weibchen häufig noch ein fast strichförmiges drittes. Der Schnabel ist zur Spitze hin dunkel, am Ansatz hell hornfarben, die Wachshaut ist dottergelb; ebenso gefärbt sind die ab dem Intertarsalgelenk ungefiederten Beine. Die Iris der Augen ist dunkelbraun.[2]
Jugendgefieder
Insgesamt ähnelt das Jugendgefieder bereits sehr stark dem Adultkleid. Der Farbton tendiert in unterschiedlichem Ausmaß ins Bräunliche. Auf dem gesamten Körper verteilt, stärker jedoch auf der Bauchseite zeigen sich weiße Flecken und Tupfen. Das zweizonale Färbungsmuster der Unterflügel ist noch deutlicher als bei Erwachsenen, da die Schwingen aufgrund der schwächeren dunklen Linierung heller erscheinen. Deutlich unterscheidet sich die Färbung des Schwanzes: Dieser ist auf der Oberseite graubraun und nur undeutlich gebändert, auf der Unterseite wie die Schwingen gefärbt und nur schwach gebändert.[1]
Mauser
Zur Mauser gibt es kaum Angaben. Die Küken vermausern ihre Schlupfdunen im Nest und tragen beim Ausfliegen das Jugendgefieder. Ob die Großfedern zu dieser Zeit schon ihre volle Länge erreicht haben, ist nicht bekannt, jedenfalls sind die Jungvögel beim Verlassen des Nests voll flugfähig. Ob im zweiten Lebensjahr eine Mauser in ein Immaturgefieder erfolgt, und wann die Mauser ins Adultgefieder stattfindet, ist ebenso unbekannt wie die Mausersequenz der Adulten.[2]
Stimmrepertoire
Die Art ist akustisch nur in der Vorbrutzeit auffällig. Häufigster, zu dieser Zeit zu hörender Ruf, ist ein sehr lang gezogener, polyfon nasaler, in der Tonhöhe abfallender und ausklingender Ruf.[7] Der Kommunikationsruf zweier fliegender Vögel ist eine gereihte Ruffolge, die eher einen Pfiffcharakter aufweist.[8] In der Nestlingszeit ist vom Weibchen bei Anflug des beutetragenden Männchens oft ein Stakkato heller, spitzer, aber nicht besonders lauter Rufe zu hören.[9]
Verbreitung
Brutgebiet
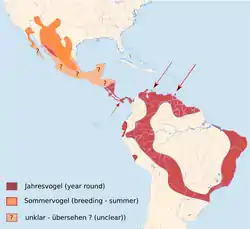
Bis auf die gut erfassten Brutvorkommen in den USA, sind sowohl das genaue Verbreitungsgebiet als auch die Bestandsdichte in vielen Bereichen des wahrscheinlichen Brutareals weitgehend unbekannt; im Besonderen gilt das für den zentralen und südlichen Teil Mexikos und die meisten Staaten Mittelamerikas. Die Art kommt überall nur zerstreut vor und ist nirgendwo häufig.
In den USA brüten einige Paare im südlichen und zentralen New Mexico; etwas dichter ist der Brutbestand im westlichen Arizona und im südwestlichen Texas. Zunehmende Brutzeitbeobachtungen im südwestlichen Utah und im südlichen Nevada deuten auf eine leichte Nordausweitung des Brutareals hin. In Nevada wurde auch 2005 die erste Brut festgestellt[10]. Gelegentlich brütet der Rußbussard im südlichsten Kalifornien und regelmäßig etwa bis zur Mitte der Baja California in Mexiko. Ob dort weitere Vorkommen weiter südlich bestehen ist ebenso unbekannt wie die Verbreitung der Art in weiten Teilen West-, Zentral- und Südmexikos. In Zentralmexiko ist B. albonotatus südwärts bis San Luis Potosí als Brutvogel nachgewiesen.[11] Im südlichen Sonora in Teilen Sinaloas und Durangos scheinen residente Populationen beheimatet zu sein. In Mittelamerika sind Brutvorkommen in Nicaragua, Costa Rica sowie in etwas größerer Dichte in Panama bekannt.
.JPG.webp)
In Südamerika ist das Verbreitungsgebiet zwar sehr ausgedehnt, doch soweit bekannt, kommt die Art nirgendwo flächendeckend vor. Noch weit in das 20. Jh. hinein wurden alle Sichtungen der Art für Zugvögel aus dem Norden gehalten.[11] Das Verbreitungsgebiet umschließt in einem annähernd geschlossenen Gürtel das Amazonasbecken. Von Kolumbien meist östlich der Anden südwärts über das östliche Ecuador und das östliche Peru bis Ostbolivien; im Süden bestehen Brutvorkommen in Paraguay und Nordargentinien. In Brasilien ist bis auf eine Lücke am Amazonasdelta ein unterschiedlich breiter Gürtel an der Atlantikküste Brutgebiet; Teile des südöstlichen und südlichen Cerrados (Provinzen Mato Grosso, Mato Grosso do Sul und Goiás) scheinen jedoch nicht besiedelt zu sein. Aus dem nördlichen Südamerika werden aus dem Norden der Guayanastaaten, sowie aus Nord- und Zentralvenezuela Brutvorkommen gemeldet. Besiedelt sind auch Trinidad, Paraguaná und wahrscheinlich einige kleine Pazifikinseln Costa Ricas und Panamas. Westlich des Andenhauptkammes bestehen zwei isolierte Verbreitungsinseln im Umland von Guayaquil in Ecuador, sowie in der Provinz Pisco in Peru.[1]
Lebensraum

Der Rußbussard besiedelt von den Küstenebenen bis in Bergregionen von bis zu 3000 Metern über NHN unterschiedliche Klimazonen und Habitatstypen. Er meidet weitgehend intensiv agrarisch genutzte und besiedelte Gebiete, seine Jagdreviere können jedoch auch solche Gebiete einschließen. In den Niederungen erscheint er vor allem in flussbegleitenden Gehölzen und Laubwäldern, aber auch in trockenem, nur vereinzelt baumbestandenem Buschland. Neben einem ausreichenden Nahrungsangebot ist Wassernähe ein wesentliches Requisit eines guten Brutreviers. Häufig brütet die Art in bewaldeten Canyons, bevorzugt dort, wo es Bestände mit alten Pappeln (Populus fremontii und andere) gibt. Häufig liegen Brutreviere an der bewaldeten Basis steiler Felsformationen. In Mexiko liegen viele Brutplätze in aufgelockerten Kiefern – Eichen Mischwäldern, aber auch in zerklüftetem Gebirgsland mit einzelnen Büschen und Bäumen. Feuchte Küstenwälder (gelegentlich auch verbuschtes Marschland) und ihr trockener werdendes, locker baumbestandenes Hinterland bis zum Übergang in saisonal feuchte bis trockene Savannen (Caatinga und Cerrado), sowie die Llanos im Norden sind die bevorzugten Bruthabitate der Art in den Niederungen Südamerikas. In den Vorbergen der Anden finden sich die meisten Brutplätze in zerklüfteten, eher trockenen Gebirgslandschaften mit eingebetteten Gebirgsoasen und in engen Talschluchten mit steilen Felsabbrüchen. Mäßig feuchte Küstenregionen sind das Brutgebiet der Art an der Pazifikküste.[1][11][10]
Rußbussarde etablieren ein Brutterritorium, das sie sehr nachdrücklich auch gegenüber bedeutend größeren Arten wie etwa dem Steinadler verteidigen. Selbst Menschen attackiert die Art, wenn sie dem Nest zu nahe kommen.[12] Das Brutrevier ist relativ klein, da es nicht, oder nur zum Teil mit dem Jagdgebiet korrespondiert. Die Beuteflüge führen die Art in vergleichsweise große Entfernungen (bis zu 26 Kilometer.[10]) vom Nest. Die Grenzen der Territorien sind oft durch die Topografie des Gebietes (Tal, Canyon) vorgegeben.
Wanderungen
Die Brutvögel der USA und des nördlichen Mexiko sind Zugvögel mit weitgehend unbekannten Überwinterungsgebieten. Bekannt sind bisher nur Überwinterungsgebiete in Nayarit an der Pazifikküste, Puebla in Zentralmexiko und Tamaulipas an der Golfküste. Auch in den meisten Staaten Mittelamerikas dürften Rußbussarde überwintern. Sie verlassen ihre Brutplätze ab Mitte September und kehren frühestens gegen Ende Februar/Anfang März zurück.[11] Einige Individuen dieser Brutregionen verbleiben auch das gesamte Jahr über im Brutrevier; andere wechseln nur in tiefer gelegene Gebiete oder verstreichen westwärts an die Pazifikküste oder ostwärts nach Westlouisiana. Im Dezember 2005 wurde ein adulter Rußbussard in Südflorida festgestellt; ob dies ein Einzelfall war, oder ob die Art regelmäßig in diesen Regionen überwintert, ist ungewiss.[13] Rußbussarde scheinen oft einzeln zu ziehen, jedenfalls sind keine Zugkonzentrationen bekannt. Häufig jedoch vergesellschaften sie sich mit Truthahngeiern, wodurch sie sehr leicht sowohl als Brutvögel als auch als Migranten übersehen werden können. In Mittelamerika deutet eine signifikante Zunahme von Sichtungen der Art in den Monaten November und Dezember beziehungsweise Februar auf einen Durchzug von Rußbussarden nach Südamerika, beziehungsweise in Richtung Mexiko hin. Wo dort die Überwinterungsgebiete liegen, ist ebenso unbekannt, wie eventuelle Wanderungen der südamerikanischen Brutvögel.[11] Einflüge in Gebiete, in denen die Art sonst nicht beobachtet wird, lassen aber (zumindest kleinräumige) Wanderungen vermuten.[1]
Nahrung und Nahrungserwerb
Zu diesen Aspekten bestehen einige Untersuchungen aus den USA und eine vergleichende Studie aus Durango/Mexiko. Fast keine Informationen liegen aus Südamerika vor.
Der Rußbussard scheint ein ziemlich anpassungsfähiger Prädator zu sein, bei dem jene Tiere zur Hauptbeute werden, bei denen das Verhältnis aus Aufwand und Energiegewinn am günstigsten ist. Generell scheinen Vögel und Reptilien im Nahrungsspektrum der Art stärker im Vordergrund zu stehen, als bei anderen Bussardarten.
In Hinblick auf die Biomasse dominieren kleine Säugetiere wie Antilopenziesel, Baumwollschwanzkaninchen,[10] Streifenhörnchen,[14] in Mexiko vor allem Baumwollratten[15] und Vögel bis zu Taubengröße (Häher, Spechte, vor allem aus den Gattungen Colaptes und Melanerpes, Montezumawachteln und viele unterschiedliche Sperlingsvögel).[10][15][14] Die prozentuale Verteilung dieser zwei Nahrungskomponenten variiert sowohl regional als auch saisonal. Reptilien haben immer einen großen Anteil an der Gesamtbiomasse; auch sie können bei entsprechendem Angebot zu den wesentlichsten Energielieferanten werden; vor allem als Nestlingsnahrung scheinen sie eine besondere Rolle zu spielen.[14]

Echsen aus der Gattung Crotaphytus wie etwa der Halsbandleguan sowie Stachelleguane werden am häufigsten erbeutet.[15] Aus dem Südosten Brasiliens wurde der Rußbussard bei einer erfolgreichen Jagd auf den Buntleguan beobachtet.[16] Regelmäßig, jedoch ohne große Bedeutung in Hinblick auf die Biomasse, erbeutet der Rußbussard Amphibien und Insekten.[14] Echsen und Vögeln beißt er vor dem Konsum oft die Köpfe ab, größere Vögel rupft er teilweise.
Der Rußbussard jagt gelegentlich auch von einem Ansitz aus, ist aber hauptsächlich einer der wenigen Bussarde, der den Großteil seiner Nahrung mittels Flugjagd erbeutet. Entweder sucht er in einem langsamen und niedrigen Ruderflug konsequent sein Nahrungsrevier nach potenzieller Beute ab, oder er kreist in bedeutend größerer Höhe, wobei er sich sehr oft unter kreisende Truthahngeier mischt. Dieses Verhalten wird häufig als aggressive Mimikry gedeutet. Der biologische Vorteil dieses Verhaltens könnte darin liegen, dass potenzielle Beutetiere an den Anblick kreisender Truthahngeier gewöhnt sind und wissen, dass ihnen von diesen Vögeln keine Gefahr droht. Der Rußbussard könnte sich so seiner Beute unbemerkt nähern. Eine Untersuchung scheint diese Ansicht insofern zu bestätigen, als 30 % der Attacken aus einer Gruppe mit Truthahngeiern heraus erfolgreich verliefen, jedoch nur 7 %, wenn der Bussard allein jagte.[3][10] Hat er ein Beutetier im langsamen Suchflug ausgemacht, stürzt er sofort zu Boden, ergreift es mit ausgestreckten Beinen und tötet es mit einem Nackenbiss. Erblickt er eines in einer Gruppe mit Truthahngeiern, versucht er so lange in dieser Gruppe zu bleiben, bis ihm der Zeitpunkt für einen Sturzflug mit halb angelegten Flügeln günstig erscheint; erst kurz vor der Erdoberfläche stoppt er und schlägt die Beute am Boden. Wenn er sie nicht sofort am Boden frisst, trägt er sie in den Fängen zu einem Fressplatz oder zum Nest. Vögel und Insekten erbeutet er sowohl im Flug als auch auf dem Boden, streift sie von Ästen ab, oder ergreift sie an Baumstämmen oder Ästen.[1][6]
Brutbiologie
Dauer und Art der Paarbindung sowie das Bruteintrittsalter sind nicht bekannt. Brutbeginn ist in den USA frühestens in der letzten Märzdekade mit einem Gipfel zwischen Mitte April und Anfang Mai, in Mexiko ab Anfang März und noch etwas früher in Mittelamerika. Aus Südamerika bestehen nur wenige phänologische Daten: Trinidad: Februar – März; Kolumbien: August; Venezuela: April.[6] Ansonsten wird angenommen, dass Rußbussarde während der regionalen Trockenzeiten brüten. Sie brüten einmal im Jahr; Ersatzgelege sind nicht die Regel und wenn, dann nur bei frühem Gelegeverlust. Die Nestortstreue scheint groß zu sein; alte Nester werden häufig wieder instand gesetzt. Häufig werden mehrere Nester pro Brutsaison errichtet.[17]
Paarbildung, Nestbau und Nest
Ob sich die Paare in jedem Jahr neu finden, oder ob es (gelegentlich oder häufig) zu Wiederpaarungen letztjähriger Brutpartner kommt, ist unklar. Es bestehen Hinweise, dass einige Rußbussarde schon angepaart aus dem Winterquartier zurückkommen.[17] Unmittelbar nach Ankunft im Brutrevier beginnt das Männchen mit Ausdrucksflügen über dem Territorium, zeigt sich an exponierten Stellen und ruft häufig. Nachdem sich ein Paar gefunden hat, überfliegt es in betont langsamen Schauflügen das Revier, steigt hoch auf und stürzt trudelnd, nicht selten einander mit den Krallen umfassend, zum Kronendach ab, um sich kurz davor zu lösen. Auch der Nestbau selbst, der bald nach den ersten Balzflügen beginnt, ist Teil der Paarbildung. Die Vögel halten aber auch in dieser Zeit voneinander Abstand und sind – außer bei den Kopulationen, selten in einer kleineren Entfernung als 3 Meter zu sehen.
Das Nest wird sehr häufig in Nordlage, hoch (7,5 – 30 Meter) in Bäumen oder (seltener) auf Felsvorsprüngen im letzten Drittel der Felsformation errichtet. Nestträger sind im Norden unterschiedliche Baumarten, oft Pappeln, Erlen, Quercus emoryi und die Ponderosa-Kiefer. Nach oben ist das Nest oft völlig sichtgeschützt und auch bei Felsbruten wählt die Art vornehmlich Stellen, die auch nach oben einen gewissen Schutz bieten und im Idealfall mit einzelnen Büschen bewachsen sind. Fast immer ist der Neststandort nicht weit von einer permanenten Wasserstelle entfernt. Das Nest ist eine weitgehend runde, stabile Konstruktion aus Zweigen und Ästchen, innen oft mit Rindenstücken ausgelegt, die von Wacholderbäumen abgelöst werden. Außen und innen wird es mit frischen Zweigen unterschiedlicher Laubbäume ausgelegt, die regelmäßig bis in die Nestlingszeit hinein, erneuert werden. Bei mehrmaliger Verwendung kann es zu einer beachtlich großen Konstruktion anwachsen. Erstbauten weisen Durchschnittsmaße von 60 Zentimetern im Durchmesser und 50 Zentimetern in der Höhe auf.[17][6] Wie lange der Konstruktionsprozess dauert und ob eine Arbeitsteilung beim Nestbau besteht, ist nicht bekannt. Der Abstand zwischen zwei beflogenen Nestern beträgt meist über einen Kilometer, nur in besonders günstigen Gebieten kann er auch geringer sein.[18][10]
Gelege, Brut- und Nestlingszeit
Das Gelege besteht aus zwei (1 – 3) mattweißen Eiern, die manchmal einen leicht bläulichen Ton aufweisen und eher selten an einem Ende lila oder rosa getupft sind. Ihre Durchschnittsmaße betragen 57,7 x 44,3 Millimeter.[6] Sie werden fast ausschließlich vom Weibchen 28 – 35 Tage bebrütet.[17][1] Beim Schlupf sind die Küken mit grauweißen Dunen bedeckt; sie können den Kopf aufrecht halten und sitzen. Mit 12 Tagen können sie stehen und die Steuerfedern und ersten Schwingen beginnen durchzubrechen. Etwa ab dem 20. Tag sind sie imstande, Beutetiere selbstständig zu zerlegen; spätestens ab diesem Zeitpunkt beteiligt sich auch das Weibchen wieder an der Jagd, das bisher vom Männchen mitversorgt wurde. Fratrizid wurde beobachtet, scheint aber nicht regelmäßig vorzukommen. Je nach Witterungs- und Nahrungsbedingungen verlassen die Nestlinge zwischen dem 41. und 51. Tag nach dem Schlupf das Nest. Die Großfedern sind zu diesem Zeitpunkt entwickelt und die Jungvögel sind flugfähig.[17][6] Die Jungvögel bleiben die erste Woche in unmittelbarer Nestnähe und dehnen ihren Aktionsradius nach und nach aus. Sie werden noch mindestens 4 Wochen von den Altvögeln mitversorgt, bevor sie selbstständig zu jagen beginnen und die Nestumgebung verlassen.[17]
Zu Bruterfolg und Reproduktionsrate liegen keine aussagekräftigen Untersuchungsergebnisse vor. 8 beobachtete Bruten in Texas brachten 1975 1,14 Junge zum Ausfliegen, im Jahr darauf aber nur 0,78. Mit 0,45 ausgeflogenen Jungen pro begonnener Brut brauchte eine Untersuchung in New Mexico noch niedrigere Ergebnisse. Womit dieser sehr niedrige Bruterfolg zusammenhängt, ist nicht bekannt.[19] Auch zur Lebenserwartung liegen kaum Ergebnisse vor. Ein nestjung beringter Vogel wurde nach 4 Jahren und einem Monat tot wiedergefunden.[6]
Systematik
Buteo albonotatus wurde 1847 von Johann Jakob Kaup anhand eines aus Mexiko stammenden Balges erstbeschrieben. Schon 1844 hatte George Robert Gray diesen Balg aus dem British Museum unter dem gleichen Namen katalogisiert, aber nicht beschrieben.[20] Harry Kirke Swann bemängelt die Qualität von Kaups Erstbeschreibung, sagt aber, dass sie Gültigkeit habe, da Gray's Katalognotiz ein nomen nudum sei und Jean Louis Cabanis Beschreibung und Benennung (Buteo abbreviatus) ein Jahr später erfolgte. Bis sich der Name B. albonotatus allgemein durchsetzte, wurden verschiedene andere Binomen (Tachytriorchis albinotatus, Buteo zonocercus, Buteo abbreviatus und andere) verwendet.[20]
Mit Stand Ende 2019 gilt der Rußbussard als monotypisch; die oft etwas kleineren und kurzschwänzigeren Vögel aus Mittel- und Südamerika, die gelegentlich als Unterart abbreviatus diskutiert wurden, gelten als klinale Größenvariationen.[6]
Die Verwandtschaftsverhältnisse sind noch nicht restlos geklärt. Bisherige molekulargenetische Ergebnisse stellen den Rußbussard in die Nähe von Buteo jamaicensis und Buteo ventralis.[21]
Bestand und Bedrohung
Bestandseinschätzungen und Analysen zur Populationsdynamik, die auf überregionalen quantitativen Untersuchungen beruhen, existieren nicht. Alle Angaben zum Gesamtbestand basieren auf Hochrechnungen, deren Grundlage kleine, regionale Erhebungen waren; entsprechend stark streuen die Ergebnisse. Ferguson-Lees bezeichnet die Art als nirgendwo häufig und beziffert den Gesamtbestand mit 4, was in seiner Nomenklatur maximal 10.000 Individuen bedeuten würde.[1] Ohne Quellen zu nennen, geben Partners in Flight einen Gesamtbestand von 2 Mio. an, eine Zahl, die auch das HBW übernommen hat und die alle anderen Angaben extrem übertrifft.[22] Die IUCN gibt keinen Gesamtbestand an, bewertet den Populationstrend mit increasing = zunehmend und die Gefährdungssituation mit LC = least concern/nicht gefährdet. Als Gesamtfläche des Brutareals werden 22,3 Mio. km² genannt.[23]
Außer einer Reihe von Prädatoren (Greifvögel, dem Virginia-Uhu, Mardern, Waschbären und möglicherweise auch Schlangen), die vor allem den Gelegen und Nestlingen gefährlich werden, gehören Lebensraumzerstörung und zunehmende Freizeitaktivitäten selbst in entlegenen Gebieten, in Mittel- und Südamerika möglicherweise auch sowohl primäre als auch sekundäre Vergiftung zu den wesentlichsten Bedrohungsfaktoren. Besonders empfindlich reagiert die Art auf Störungen in Nestnähe. Lebensräume in engen Tälern und Canyons sind vor allem durch Dammbauprojekte bedroht. Auch von direktem Abschuss könnte in manchen Regionen des großen Verbreitungsgebietes ein gewisses Gefährdungspotenzial ausgehen.[19]
Literatur
- R. O. Bierregaard Jr., G. M. Kirwan und J. S. Marks: Zone-tailed Hawk (Buteo albonotatus). In: J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, und E. de Juana (Hrsg.): Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona 2019 (heruntergeladen von https://www.hbw.com/node/53132 am 9. Dezember 2019).
- James Ferguson-Lees, David A. Christie: Raptors of the World. Houghton Mifflin, Boston 2001, ISBN 0-618-12762-3, S. 206; 675 – 677.
- R. R. Johnson, R. L. Glinski und S. W. Matteson: Zone-tailed Hawk (Buteo albonotatus). Version 2.0. In: The Birds of North America (A. F. Poole F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000; https://doi.org/10.2173/bna.529
- Scott H. Stoleson und Giancarlo Sadotti: Zone-tailed Hawk (Buteo albonotatus) Publikation des US Forest Service. pdf engl.
Einzelnachweise
- James Ferguson-Lees, David A. Christie: Raptors of the World. Houghton Mifflin, Boston 2001, ISBN 0-618-12762-3, S. 990; S. 675 – 677.
- R. R. Johnson, R. L. Glinski und S. W. Matteson: Zone-tailed Hawk (Buteo albonotatus). Version 2.0. In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000; https://doi.org/10.2173/bna.529 Introduction and Appearance
- Edwin O. Willis: Is the Zone-Tailed Hawk a Mimic of the Turkey Vulture? In: The Condor; Jhrg. 65, Band 4; 1963. S. 313 – 317 html engl.
- R. R. Johnson, R. L. Glinski und S. W. Matteson: Zone-tailed Hawk (Buteo albonotatus). Version 2.0. In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000; https://doi.org/10.2173/bna.529
- BirdLife International: Species Factsheet – Zone-tailed Hawk (Buteo albonotatus). Abgerufen am 23. Februar 2022.
- R. O. Bierregaard Jr., G. M. Kirwan und J. S. Marks: Zone-tailed Hawk (Buteo albonotatus). In: J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, und E. de Juana (Hrsg.): Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona 2019 (heruntergeladen von https://www.hbw.com/node/53132 am 9. Dezember 2019).
- Xeno-canto: Revierruf
- Xeno-canto: Flugruf.
- R. R. Johnson, R. L. Glinski und S. W. Matteson: Zone-tailed Hawk (Buteo albonotatus). Version 2.0. In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000; https://doi.org/10.2173/bna.529 Sounds and Vocal Behavior
- Scott H. Stoleson und Giancarlo Sadotti: Zone-tailed Hawk (Buteo albonotatus). Publikation des US Forest Service
- R. R. Johnson, R. L. Glinski und S. W. Matteson: Zone-tailed Hawk (Buteo albonotatus). Version 2.0. In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000 Distribution
- R. R. Johnson, R. L. Glinski und S. W. Matteson: Zone-tailed Hawk (Buteo albonotatus). Version 2.0. In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000; https://doi.org/10.2173/bna.529 Introduction
- Thomas J. Wilmers: First record of a Zone-tailed Hawk in Florida.In: Florida Field Naturalist. Jhrg. 33; Band 2; 2005. Seiten 51 – 52. pdf engl.
- R. R. Johnson, R. L. Glinski und S. W. Matteson: Zone-tailed Hawk (Buteo albonotatus). Version 2.0. In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000 Diet and Foraging
- F. Hiraldo, M. Delibes, J. Bustamante und R. Estrella: Overlap in the Diets of diurnial Raptors breeding at the Michilía Biosphere Reserve, Durango, Mexico. In: The Journal of Raptor Research Jhrg. 25, Folge 2; 1994. Seiten 25 – 29.pdf engl.
- Diogo Andrade Koski, Aline P. Valadares Koski und André Felipe Barreto-Lima: Predation of Polychrus marmoratus (Squamata: Polychrotidae) by Buteo albonotatus (Accipitriformes: Accipitridae) in southeastern Brazil In: Boletim do Museu de Biologia Mello Leitão Jhrg.: 38; Folge 1 2016.pdf engl./portug.
- R. R. Johnson, R. L. Glinski und S. W. Matteson: Zone-tailed Hawk (Buteo albonotatus). Version 2.0. In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000. Breeding
- R. R. Johnson, R. L. Glinski und S. W. Matteson: Zone-tailed Hawk (Buteo albonotatus). Version 2.0. In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000. Behavior
- R. R. Johnson, R. L. Glinski und S. W. Matteson: Zone-tailed Hawk (Buteo albonotatus). Version 2.0. In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000. Demography and Populations
- Herbert Friedmann: The birds of North and Middle America. United States National Museum Bulletin. Band 50; Teil XI; Washington 1950.BHL
- F. Raposo do Amaral, F. H. Sheldon, A. Gamauf †, E. Haring, M. Riesing, L. F. Silveira, und A. Wajntal: Patterns and processes of diversification in a widespread and ecologically diverse avian group, the buteonine hawks (Aves, Accipitridae) In: Molecular Phylogenetics and Evolution Jhrg. 53; 2009; S. 703–715
- Partners in Flight Database Buteo albonotatus
- BirdLife International 2016. Buteo albonotatus. The IUCN Red List of Threatened Species 2016: e.T22695926A93534193. http://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T22695926A93534193.en. Heruntergeladen am 15. Dezember 2019.