Krabbenbussard
Der Krabbenbussard (Buteogallus anthracinus) ist ein mittelgroßer bis großer, stämmiger Greifvogel aus der Gattung Buteogallus innerhalb der Unterfamilie der Bussardartigen (Buteoninae). Die fast gänzlich schwarze oder schwarzbraune Art mit breiten, gerundeten Flügeln und kurzem gebänderten Schwanz, kommt in den südlichen USA, den Küstenbereichen Mexikos und Mittelamerikas, sowie im nördlichen und nordöstlichen Südamerika vor. Die Geschlechter sind weitgehend gleich gefärbt; Weibchen sind nur unmerklich größer, aber wesentlich schwerer als Männchen.[1] Jungvögel unterscheiden sich mit ihrer braunen Oberseite und der deutlich auf hellem Grund braun gesprenkelten Bauchseite deutlich von adulten Krabbenbussarden.
| Krabbenbussard | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
_(10460279303).v01.jpg.webp)
Adulter Krabbenbussard | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Buteogallus anthracinus | ||||||||||||
| (Deppe, 1830) |
Die im nördlichen Teil des Verbreitungsgebietes brütenden Krabbenbussarde (USA und nördliches Mexiko) sind weitgehend Zugvögel, die Vögel der übrigen Regionen Standvögel.[1][2] Die Art kommt ausschließlich in Wassernähe, bevorzugt in feuchten Habitaten, wie Mangroven, Marschen, Watten, versumpften Flussufern und ähnlichem vor, wo sie sich als Nahrungsgeneralist vorwiegend von jenen Tieren ernährt, die mit dem geringsten Aufwand zu erbeuten sind. Fische, Reptilien und auch Krabben spielen aber immer eine besondere Rolle.[3]
Laut IUCN ist Buteogallus anthracinus, von dem mit Stand Ende 2019 fünf Unterarten anerkannt werden, nicht gefährdet (LC = least concern).[4][5] Der Gattungsname (Buteogallus = Hühnerbussard) bezieht sich auf die langen Beine, das Artepitheton anthracinus (griech. ανθρακινός = holzkohlefarben) auf die Gefiederfärbung der Art.[6]
Aussehen
Der Krabbenbussard ist ein mächtiger, massiv gebauter, fast einheitlich schwarzer oder schwarzbrauner Bussard mit langen Beinen und kurzen, breiten, vor allem im Bereich der Armschwingen deutlich gebuchteten Flügeln. Der kurze, meist breit gefächerte Schwanz weist eine markante, breite, weiße Mittelbinde auf. Er fliegt mit langsamen, kräftigen, tief durchgezogenen Flügelschlägen und segelt mit annähernd waagrecht gehaltenen Flügeln. Ein Färbungsdimorphismus besteht nicht, der reverse Größendimorphismus ist marginal und kann nicht zur Geschlechtsbestimmung herangezogen werden. Wesentlich deutlicher ist der Gewichtsdimorphismus. Jungvögel sind mit brauner Oberseite und gesprenkelter Unterseite deutlich unterschiedlich gefärbt. Männchen wiegen durchschnittlich 790 , Weibchen 1200 Gramm. Die Größe liegt im Bereich von 50 – 56 Zentimetern.[2]
Der Krabbenbussard kann leicht mit dem Mohrenbussard, dem er bis auf Habitus und Färbung des Schwanzes weitgehend gleicht, und im Süden des Verbreitungsgebietes mit dem sehr ähnlich gefärbten, aber etwas größeren Schwarzbussard verwechselt werden.


Adultgefieder
Die gesamte Ober- und Unterseite des sitzenden Vogels ist schwarz mit leichten Brauntönen, die sich mit zunehmender Abnutzung des Gefieders verstärken. Der Kopf ist ebenfalls schwarz; heller, oft rehbraun, ist eine Region hinter der Schnabelbasis; über dem Schnabelansatz zeigt sich oft eine weißliche Stelle. Bei gesträubten Nackenfedern sind deren weiße Basen erkennbar. Aus der Nähe ist die geringfügig hellere Randung der Konturfedern und eine undeutliche Bänderung der Schwingenoberseite und des befiederten Laufbeins zu erkennen; dadurch entsteht vor allem im frischen Gefieder ein marmorierter oder gewellter Eindruck. Der Schwanz überragt die Flügelspitzen deutlich. Beim fliegenden Vogel ist die Buchtung der Flügel im Bereich der Armschwingen auffällig. Die Schwingenunterseite ist leicht rötlichbraun und undeutlich schwarzgrau gebändert. Die Handschwingen sind in der terminalen Hälfte deutlich dunkler als in der basalen, die Armschwingen deutlich dunkel gerandet. Die beiden äußersten Handschwingen sind in der basalen Hälfte teilweise weiß, wodurch auf der Unterseite der Flügel eine längliche weiße Region entsteht. Der schwarze, weiß gerandete Schwanz weist annähernd in seiner Mitte auf Ober- und Unterseite ein markantes weißes Band auf. Die Beine sind orangegelb. Der mächtige Hakenschnabel ist an der Spitze dunkel hornfarben, zum Ansatz hin von einer dottergelben Wachshaut überzogen. Die Iris ist dunkelbraun.[2]
Jugendgefieder
Jungvögel haben einen längeren Schwanz und deutlich schmälere, geringer gebuchtete Flügel. Das Oberseitengefieder ist dunkelbraun; viele Federn sind hellbraun oder mattweiß gerandet, wodurch ein gefleckter Eindruck entsteht. Das Kopfgefieder ist heller und strähnig dunkelbraun durchsetzt. Deutlich ist ein hellbrauner Überaugenstreif. Das Unterseitengefieder ist auf cremefarbenem Grund unregelmäßig dunkelbraun getropft, ebenso die Unterflügeldecken, die jedoch intensiv schwarz gestrichelt und gefleckt sind. Die bräunlichen Schwingen sind eng schwarz liniert. Der im Vergleich zu Adulten etwas längere und schmälere Schwanz weist einige unterschiedlich breite dunkelbraune Bänder auf und schließt mit einem breiten, dunklen Band ab. Der Schnabel ist etwas heller als der Ausgefärbter, die Wachshaut tendiert ins Grüngelbliche. Ebenso sind die Laufbeine gefärbt. Die Iris ist dunkelbraun.[1][2]
Vor allem in Panamá werden mit einer gewissen Regelmäßigkeit blassbraune Jungvögel mit weißen Gefiederanteilen beobachtet. Wahrscheinlich handelt es sich bei ihnen um schizochrome Vögel, die kaum das Erwachsenenalter erreichen.[1][7]
Mauser
Die Abfolge der Mauser ist nicht völlig klar und variiert wahrscheinlich je nach Brutgebiet. Die folgenden Angaben gelten für nordamerikanische Vögel.
Küken beginnen mit 15 Tagen mit dem Federwechsel in das erste Jugendgefieder, der mit dem Verlassen des Nestes abgeschlossen ist. Nicht alle Großfedern sind zu diesem Zeitpunkt voll entwickelt. Vom ersten Wegzug kehren die Jungvögel mit unterschiedlichen Merkmalen (meist einige schwarze Steuerfedern und einige voll ausgefärbte Schwingen) des ersten Erwachsenengefieders zurück; offenbar hat im Winterquartier ein teilweiser Wechsel des Großgefieders stattgefunden. Im weiteren Verlauf des Frühjahres vermausern sie das gesamte Gefieder und tragen danach das erste Erwachsenenkleid. Dieses ist relativ nahe dem endgültigen Adultgefieder, nur die Bauchseite ist noch immer gefleckt und die Schwingen weisen auf der Unterseite das zweizonale Aussehen des Jugendgefieders auf, sind aber dunkler als dieses. Es ist nicht klar, ob sie bereits im darauffolgenden Jahr in das definitive Erwachsenengefieder wechseln, oder ob noch eine Komplettmauser mit einer weiteren Annäherung an das Adultgefieder stattfindet. Danach erfolgt jährlich ein kompletter Federwechsel (Weibchen während der Brutzeit, Männchen danach. Ziehende Bussarde unterbrechen die im Brutgebiet begonnene Mauser und komplettieren sie im Überwinterungsgebiet).[2]
Stimme
Krabbenbussarde sind das gesamte Jahr über zu hören; in der Vorbrutzeit sind sie akustisch besonders auffällig. Der Hauptruf, der situativ vielfältig variiert und angepasst wird, ist eine Serie von schrillen, oft überkippenden, kurzen und hohen Ruffolgen mit polyfoner, quietschender, zuweilen auch nasaler Klangcharakteristik; die Rufe erinnern eher an Specht- oder Falkenrufe als an die eines Bussards. Die Tonhöhe nimmt anfangs zu und das Intervall zwischen den Einzelelementen verkürzt sich; meist ab der Mitte der Ruffolge fällt die Tonhöhe wieder ab und der Ruf klingt aus.[8] Nur wenige Elemente umfassende Ruffolgen in ruhigerer, weniger schriller Tonlage, dienen als Kommunikationsruf.[9]
Verbreitung
Brutgebiet
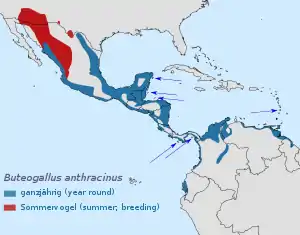
Der Krabbenbussard kommt vom Süden der Vereinigten Staaten (zentrales und südliches Arizona, südwestliches New Mexico und südliches Texas; gelegentlich auch südliches Utah) südwärts über Mexiko, wo er in einem unterschiedlich breiten Streifen die pazifischen Küstengebiete und jene an der Golfküste besiedelt, bis Mittelamerika vor, wo er ebenfalls an beiden Küsten Brutvogel ist, im Innenland aber wie in Mexiko weitgehend fehlt. Brutvorkommen bestehen in den Küstenregionen Yucatáns und auf einigen vorgelagerten Inseln (Isla de Cozumel, Islas de la Bahía, beziehungsweise Isla del Rey und anderen, der panamaischen Küste vorgelagerte Inseln). In Südamerika ist ein Küstenstreifen an der Karibikküste im Norden Kolumbiens, Venezuelas und Westguayanas Brutgebiet. Auch auf Trinidad und St. Vincent brütet die Art. Weitere Vorkommen bestehen an der kolumbianischen Pazifikküste und etwas isoliert in der Provinz Guayas in Ecuador. (Vor allem in den Küstenregionen des Golfes von Guayaquil und den vorgelagerten Inseln)[10] Brutzeitbeobachtungen liegen auch aus dem nördlichsten Peru vor. In Kolumbien reichen die Brutvorkommen entlang des Río Magdalena (und wahrscheinlich auch entlang des Río Meta) weit ins Innenland.[1]
Lebensraum

Die Bruthabitate dieser Art liegen immer am, oder in der Nähe von Wasser, sei es an der Meeresküste oder in den Uferregionen von Wasserläufen. Dauernd wasserführende Gerinne sind wesentlich, zumindest aber müssen während der Trockenperioden größere stehende Wasserflächen oder Sumpfabschnitte bestehen bleiben. So weit die Brutgebiete nicht an der Küste liegen, wo Mangrove der bevorzugte Lebensraum ist, brütet die Art in flussbegleitenden Gehölzen und Galeriewäldern unterschiedlicher Baumzusammensetzung. Dichtere Bestände mit hohen, alten Bäumen (Pappeln, Weiden, Sycomoren, Föhren, in Mexiko und Mittelamerika häufig Pithecellobium dulce und in höher gelegenen Gebieten Eichen und Arctostaphylos sp.) werden nur vereinzelt stehenden Bäumen deutlich vorgezogen. An der Küste besiedelt er die meerseitigen Bereiche von Mangrove, sowie die Ränder von Küstenlagunen, Randzonen von Schwemmebenen, Marschen, überflutete Waldgebiete und baumbestandenes, dauernd feuchtes Grasland mit stehenden Pfützen und Teichen. Kultiviertes, besiedeltes Land meidet der Krabbenbussard, extensive Viehzucht toleriert er jedoch. In montanen Gebieten brütet er ausschließlich in Galeriewäldern entlang von dauernd wasserführenden Flüssen.[11]
Sofern Krabbenbussarde nicht an der Küste vorkommen, können sie entlang von Wasserläufen hochgelegene Gebiete von an die 2000 Meter über NHN besiedeln (Arizona, Mexiko), die Hauptverbreitung liegt jedoch in Regionen unter 500 Metern.[5]
Die Reviere erstrecken sich linear entlang von Fließgewässern oder Meeresküsten, und reichen, je nach Topographie des Gebietes, unterschiedlich weit in das Hinterland. Die lineare Ausdehnung des Jagdgebietes entlang eines Flusses oder der Küste schwankt zwischen 0,67 und 2,7 Kilometern. Die höchste in Mexiko festgestellte Brutdichte betrug 0,34 Paare/Kilometer. An einem 80 km langen Flussabschnitt eines Nebenflusses des Río Yaqui wurden 8 Brutpaare festgestellt.[12] Die Brutortstreue ist sehr groß. Wahrscheinlich bleiben viele Krabbenbussarde ihr Leben lang in einem Brutterritorium.[12]
Wanderungen
Nur die nördlichsten Brutpopulationen verlassen ihre Brutreviere, die Vögel aller anderen Brutpopulationen verbleiben jahrüber weitgehend im Brutrevier. Der Wegzug findet unmittelbar nach Selbstständigwerden der Jungvögel im August und September statt, im März und April erfolgt die Rückkehr.[5] Ob Regionen im zentralen Mexiko, wo ein in Arizona nestjung beringter Krabbenbussard wiedergefunden wurde, als Winterquartier gelten können, ist fraglich.[11]
Nahrung und Nahrungserwerb


Der Krabbenbussard ist nicht, wie sein Name nahelegt, auf Krabben spezialisiert, sondern nützt als Nahrungsgeneralist eine Vielzahl von Beutetieren.[3] Je nach geografischer Lage des Brutgebiets und der Jahreszeit treten unterschiedliche Arten in den Vordergrund. Einzelne quantitative Analysen sind also immer nur Momentaufnahmen.
Eine umfangreiche Studie, die 2008 und 2009 entlang dreier Nebenflüsse des Verde Rivers erhoben wurde,[13] stellte Krebse, Fische (Sonnenbarsche), Schlangen (Thamnophis sp.), Echsen (Stachelleguane), Froschlurche (Rana catesbeiana), kleine Säugetiere, Vögel, deren Eier und Nestlinge, Insekten und Gliederfüßer unter den Beutetieren fest. Krebse machten bei 4 der beobachteten 16 Bussardpaare über die Hälfte der zum Nest gebrachten Beutetiere aus.[13] In einer vergleichenden Studie aus Durango entfielen 86 % der Biomasse auf eine Fischart aus der Familie der Saugkarpfen, neben unterschiedlichen Großinsekten bildeten Stachelleguane den Rest.[14]
In den Mangrovegebieten Mittel- und Südamerikas gewinnen Krabben (Winkerkrabben und andere Arten aus der Familie Ocypodidae, sowie Landkrabben) an Bedeutung; wesentlich in Hinblick auf die Biomasse sind relativ große Vögel wie verschiedene Reiherarten, Ibisse (häufig Scharlachsichler) und Rosalöffler, aber auch große Frösche (Ceratophrys sp.) von denen jedoch meist nur die Hinterbeine verzehrt werden.[1] Fische sind in diesen Habitaten (Mangrove, Flachwasserlagunen, Marschen) eine regelmäßige Nahrungsquelle, seien es gestrandete, oder in Gezeitenbecken gefangene Exemplare. Unter den Säugetieren fanden sich Fledermäuse regelmäßig in den Nahrungsanalysen. Häufig wurden Krabbenbussarde an Beuteresten von Kaimanen beobachtet und auch entlang von Straßen, wo sie überfahrene Tiere verwerten. Gelegentlich wurde auch der Verzehr von Früchten festgestellt.[3][1]
Der Krabbenbussard wendet unterschiedliche Jagdtechniken an. Oft beobachtet er von einem Ansitz aus die Umgebung; sieht er ein lohnendes Tier, gleitet er meist ohne Flügelschlag von der Warte und schlägt es am Boden. Zuvor kreist er häufig in größerer Höhe, um sich einen Überblick zu verschaffen. Die Ansitze werden in rascher Folge gewechselt, wobei diese Wechsel gleichzeitig langsame, niedrige Suchflüge sind, oder in solche übergehen. Vor allem im Inneren feuchter oder überfluteter Wälder fliegt er von Baum zu Baum, beobachtet nur kurz einen Sektor, um bald wieder weiter zu fliegen. Sehr oft jagt er am Boden, watet am Ufersaum, oder sucht in Gezeitentümpeln nach Beute. Krabbenbussarde fliegen Brandkanten von Buschbränden ab, um Insekten oder fliehende Reptilien zu erbeuten und vertreiben brütende Vögel von ihren Nestern, um an ihre Eier zu gelangen. Kleine Vögel versucht er aus einer Deckung heraus im Flug zu überraschen, und oberflächennah schwimmende oder treibende Fische greift er im Vorbeiflug mit beiden Beinen wie ein Seeadler aus dem Wasser.[1][3]
Krabbenbussarde legen bei Nahrungsüberschuss Vorratsdepots an vor Räubern versteckten, trockenen Orten an.[3]
Brutbiologie
Es ist nicht genau bekannt, ob Krabbenbussarde mit zwei oder mit drei Jahren zum ersten Mal brüten. Wahrscheinlich findet nur eine Jahresbrut statt, Ersatzgelege, frühestens etwa einen Monat nach Gelegeverlust, sind jedoch häufig.[15]
Legebeginn in Arizona ist Anfang/Mitte April, etwas früher beginnt die Eiablage in Mexiko. Frische Gelege wurden im Januar in Kolumbien gefunden, zwischen Januar und Mai in Panama und zwischen März und Juli auf Trinidad. In den übrigen Gebieten brütet die Art wahrscheinlich in den jeweiligen Trockenzeiten.[1][12]
Die Brutortstreue ist sehr groß. Wahrscheinlich bleiben viele Krabbenbussarde ihr Leben lang in einem Brutterritorium. Alte Nester werden sehr häufig wiederverwendet (ein Nest wurde in 11 Jahren jährlich genutzt), aber auch die Nester anderer Greifvögel wie Rundschwanzsperber oder Mohrenbussard werden gelegentlich entsprechend adaptiert.[15]
Paarbildung, Neststandort und Nest
Die Balz besteht vor allem aus bussardtypischen, zum Teil eindrucksvollen Balzflügen. Die Partner fliegen mit akzentuierten Flügelschlägen, steigen hoch auf und stürzen trudelnd zum Blätterdach ab, wobei sie sich gelegentlich auch mit den Krallen umfassen; begleitet sind diese Schauflüge von häufigen Rufen. Futterübergaben des Männchens leiten oft eine Kopulation ein. Mit Beginn des Nestbaus nehmen die Ausdrucksflüge und die Rufaktivität ab.
Das Nest wird in sehr unterschiedlichen Höhen (2,5 – 42 (!) Meter) in verschiedenen Baumarten (Mangroven, Platanen, Weiden, Eschen, Föhren, gelegentlich auch in Opuntien und anderen) meist in einer Gabelung des Hauptstammes errichtet. Eher selten wurden Felsennester festgestellt.[15] Das Nest ist als Erstbau ein meist überraschend kleines, kugeliges Gebilde aus belaubten Zweigen, die das Männchen (vor allem vom Nestbaum) abbricht und das Weibchen verarbeitet. Innen ist es mit frischem Laub ausgelegt, das bis zum Ausfliegen der Jungen regelmäßig ersetzt wird. Da Nester jedoch häufig mehrmals wiederverwendet und regelmäßig erneuert und ergänzt werden, wachsen sie mit der Zeit zu Gebilden von über einem Meter Durchmesser an.[15]
Gelege und Jungenaufzucht
Das Gelege besteht aus 1 – 3 kurzovalen Eiern in den durchschnittlichen Maßen von 57,3 × 44,9 Millimetern. Die mattweißen, oft grünlich getönten Eier, sind, verstärkt am langen Ende, unregelmäßig rot- und dunkelbraun sowie lila gefleckt. Die Gelegegröße nimmt nach Süden hin signifikant ab.[12][15] Die Brutzeit beträgt etwa 37 Tage; während der Nacht brütet immer das Weibchen, während des Tages wird es in unterschiedlichem Ausmaß vom Männchen abgelöst.
Die Küken schlüpfen im Abstand von zwei Tagen. Beim Schlupf sind sie mit flauschigen mattweißen Dunen bedeckt; sie sind nicht fähig zu sitzen und können den Kopf kaum heben, können aber bereits nach einer Stunde kleine Nahrungsbissen zu sich nehmen. Mit drei Tagen sitzen sie im Nest und schlagen unbeholfen mit den Flügeln. Das ältere Küken beginnt sich etwa mit 8 Tagen aggressiv gegenüber seinem jüngeren Geschwister zu verhalten, was häufig zu dessen Tode führt; wenn beide Nestlinge jedoch ein vergleichbares Aggressionsniveau aufweisen, flaut diese Aggressionsphase schnell ab. Zu dieser Zeit können die Küken stehen und ihre Position im Nest verändern und die ersten Großfedern brechen durch. Wenn die Jungen imstande sind, Beutetiere selbstständig zu zerteilen oder als Ganzes zu schlucken, beginnt auch das Weibchen wieder zu jagen. Mit 36 Tagen erscheinen sie weitgehend befiedert; Dunenreste sind noch am Scheitel und in der Wangenregion zu sehen. Häufig verlassen sie dann auch zeitweilig das Nest und klettern in das nahe Geäst. Frühestens mit 43 Tagen (Durchschnitt 46,8 Tage), meist aber etwas später, sind sie eingeschränkt flugfähig und verlassen endgültig das Nest. Sie verbleiben danach noch für Tage im Brutbaum, entwickeln ihre Fluggeschicklichkeit, sind insgesamt aber noch vollkommen von den Altvögeln abhängig. Diese Führungszeit, in der die elterliche Fürsorge in dem Maße abnimmt, in der die Selbstständigkeit der Jungvögel zunimmt, dauert wenigstens zwei Monate.[15][5] Ferguson-Lees et al. berichten ohne Angabe der Herkunft sogar von Führungszeiten an die 7 Monate.[1]
Zur Dismigration der Jungvögel liegen keine Daten vor.
Bruterfolg und Lebenserwartung
Zum Bruterfolg liegen nur zwei Untersuchungen aus Arizona vor. Von 22 Nestern, die in einer Studie während 2 Brutperioden beobachtet wurden, brachten 84 % zumindest einen Jungvogel zum Ausfliegen. In der umfangreicheren zweiten Untersuchung wurden 168 Nester beobachtet, von denen 78 % Jungvögel zum Ausfliegen brachten. Die Reproduktionszahl (= Anzahl der ausgeflogenen Jungvögel pro begonnener Brut) betrug in einem Jahr 1,31, im zweiten 0,98.[12]
Krabbenbussarde können auch in freier Wildbahn ein hohes Lebensalter erreichen. Ein im Nest beringter Jungvogel wurde nach 13 Jahren und 6 Monaten wiedergefunden.[12]
Systematik
.jpg.webp)
.jpg.webp)
Pierre Guillaume (Wilhelm) Deppe fertigte 1830 ein Inventar- und Preisverzeichnis vor allem von Vogelbälgen an, die sein Bruder Ferdinand von einer ausdehnten Mexikoreise mitgebracht hatte, und fügte diesem Beschreibungen von Arten an, von denen er annahm, dass sie noch nicht beschrieben seien, darunter auch die gegenständliche Art, die er Falco anthracinus nannte.[16] Das Typusexemplar stammt aus der Provinz Veracruz in Mexico. Unklar ist, weshalb die Druckschrift nicht unter seinem, sondern unter dem Namen Martin Hinrich Lichtensteins publiziert wurde. In der wissenschaftlichen Literatur schien deshalb Lichtenstein und nicht Deppe als Erstbeschreiber auf. Dieser Irrtum fiel erst 1954 Erwin Stresemann auf, worauf die Autorenschaft dieser und einer Reihe anderer Arten von Lichtenstein zu Deppe wechselte.[17]
Unter den Schwarzbussarden ist Buteogallus anthracinus mit dem Einsiedleradler, dem Rotbauchbussard und dem Kubabussard nahe verwandt.[18][5] Der lange als konspezifisch angesehene Kubabussard wird seit 2007 als eigenständige Art angesehen. Gründe dafür waren Unterschiede in Größe, Gefiederfärbung und Stimme.[19]
Ende 2019 wurden 5 Unterarten anerkannt, die nur geringfügig in Hinblick auf Größe und Gefiederfärbung differenziert sind.[5] Zwei Gruppen lassen sich unterscheiden: die atlantische anthracinus- und die pazifische subtilis Gruppe.
- Buteogallus anthracinus anthracinus (Deppe, 1830): USA, Zentralmexiko und atlantische Küstengebiete; Nordkolumbien ostwärts bis Guayana.
- Buteogallus anthracinus utilensis Twomey, 1956: Inselrasse. Einige kleine Inseln in Golf von Honduras, sowie Inseln vor Cancún, sowie Cozumel. Etwas kleiner als Nominatform, der helle Fleck im Bereich der Handschwingen fehlt bei diesen Vögeln.[20]
- Buteogallus anthracinus subtilis (Thayer & Bangs, 1905): Pazifikküste Kolumbiens, (unsicher) Nordwestecuador, Südwestecuador und (unsicher) nördlichstes Peru. Im Durchschnitt die kleinste Rasse. Eher graubraun als grauschwarz. Der helle Fleck am Ansatz der ersten beiden Armschwingen ist deutlicher als bei der Nominatform, die Unterseiten der Armschwingen zeigen einen deutlichen rötlichbraunen Ton. B. a. subtilis wird von verschiedenen Autoritäten (Ferguson-Lees und andere) gemeinsam mit den beiden folgenden Unterarten als eigenständige Art aufgefasst; mit Stand Ende 2019 hat sich jedoch mehrheitlich die Ansicht durchgesetzt, sie als Unterart zu betrachten.[21][1]
- Buteogallus anthracinus rhizophorae Monroe, 1963: Pazifikküste von Chiapas südwärts bis Nicaragua. Etwas größer als B. a. subtilis, aber kleiner als B. a. anthracinus. Insgesamt mehr grauschwarz, als schwarz; die Armschwingen sind auf der Unterseite dunkelgrau, nicht rötlichbraun.[22]
- Buteogallus anthracinus bangsi (Swann, 1922): Pazifikküste Costa Ricas und Panamas, Perleninseln. In der Größe zwischen B. a. subtilis und B. a. rhizophorae. Leichte Brauntönung des Brust- und Bauchgefieders, sehr deutliche rostrote Tönung der Armschwingen.[21]
Bestand und Bedrohung
Alle Angaben zum Gesamtbestand der Art beruhen auf Hochrechnungen und Schätzungen, denen regionale und lokale Bestandserhebungen zugrunde liegen. BirdLife gibt als Größe des Brutgebietes über 10 Mio km² an und beziffert den Bestand der Art bei negativem Populationstrend mit 2 Mio. Individuen.[4] Ferguson-Lees geht von weniger als einem Zehntel aus.[1]
_(7-29-12)_west_of_nogales%252C_scc%252C_az_-01_(7670748928).jpg.webp)
In den nördlich gelegenen Brutgebieten (USA, nördliches und zentrales Mexiko) ist B. anthracinus regelmäßig verbreitet, aber nirgendwo häufig. Der Gesamtbestand in den USA wird auf 220–250 Brutpaare geschätzt.[5] Dichter werden die Vorkommen auf Yucatán, in Mittelamerika und an der karibischen Atlantikküste, wo Krabbenbussarde stellenweise häufig vorkommen. Auch am unteren Río Magdalena ist die Art häufig. An der Pazifikküste Kolumbiens kommt B. anthracinus zwar in allen geeigneten Habitaten vor, doch ist die Brutdichte nicht hoch. Aus den Küstengebieten Ecuadors liegen keine quantitativen Angaben vor, der Populationstrend scheint jedoch stark negativ zu sein.[10]
Hauptgefährdungsursache ist die Zerstörung des Lebensraumes. Vor allem Mangroven werden großflächig zur Holzkohlegewinnung abgeholzt oder in Becken für die Shrimpszucht umgewandelt. Häufig werden Abfälle aller Art in solchen Biotopen deponiert. Siedlungen und Hotelanlagen breiten sich in Mangrovegebiete aus. In den binnenländischen Verbreitungsgebieten führen Dammbauprojekte, die zunehmende Entwaldung der Flusssäume und steigende, unangepasste Freizeitaktivitäten zum Verlust vieler Brutplätze. Viele Brutplätze liegen nahe von Bananenplantagen, deren hoch mit Bioziden kontaminierte Abwässer in die Jagdreviere des Krabbenbussards gelangen. Die Aufnahme kontaminierter Beutetiere führt zu Krankheit und Tod, zumindest aber zu mangelnder Fitness.[10] In den bisher populationsdynamisch stabilen Brutgebieten der USA könnten Kampagnen zur Eliminierung invasiver Neozoen (Krebse, Fische) kurz- und mittelfristig negative Auswirkungen auf den Brutbestand haben. Vor allem der Viril-Flusskrebs, der in den 70er Jahren im Colorado-Flusssystem ausgesetzt wurde, hat sich dort und in Flussläufen des nördlichen Mexikos explosionsartig vermehrt.[13][23] Er ist im nördlichsten Verbreitungsgebiet ein nicht unwesentliches Beutetier des Krabbenbussards.
Literatur
- R. O. Bierregaard Jr., D. A. Christie, P. Boesman, G. M. Kirwan und J. S. Marks: Common Black Hawk (Buteogallus anthracinus). In: J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, und E. de Juana (Hrsg.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona 2019 (heruntergeladen von https://www.hbw.com/node/53111 am 16. Dezember 2019)
- James Ferguson-Lees, David A. Christie: Raptors of the World. Houghton Mifflin, Boston 2001, ISBN 0-618-12762-3, S. 990; S. 631 – 632.
- J. H. Schnell: Common Black Hawk (Buteogallus anthracinus). In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000; Version 2.0. https://doi.org/10.2173/bna.122
Einzelnachweise
- James Ferguson-Lees, David A. Christie: Raptors of the World. Houghton Mifflin, Boston 2001, ISBN 0-618-12762-3, S. 990; S. 631 – 632.
- J. H. Schnell: Common Black Hawk (Buteogallus anthracinus).In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000; Version 2.0. https://doi.org/10.2173/bna.122 Introduction and Appearance
- J. H. Schnell: Common Black Hawk (Buteogallus anthracinus).In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000; Version 2.0. https://doi.org/10.2173/bna.122 Diet
- Factsheet auf BirdLife International
- R. O. Bierregaard Jr., D. A. Christie, P. Boesman, G. M. Kirwan und J. S. Marks: Common Black Hawk (Buteogallus anthracinus). In: J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, und E. de Juana (Hrsg.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona 2019 (heruntergeladen von https://www.hbw.com/node/53111 am 16. Dezember 2019)
- James A. Jobling: The Helm Dictionary of scientific Bird Names. Christopher Helm, London 2010. ISBN 978-1-4081-2501-4
- Anmerkung: Schizochromismus ist ein Gendefekt, der bewirkt, dass Melanin vollkommen fehlt; die schwarzen Gefiederanteile erscheinen deshalb cremefarben oder mattweiß
- xeno-canto: Ruffolge
- xeno-canto: Kommunikationsruf
- Juan José Alava, Miguel Saavedra, Xavier Arosemena, Madeleine Calle, Carlos Vinueza, Pedro J. Jiménez, Raúl Carvajal und F. Hernán Vargas: Distributional records and potential threats to the Common (Mangrove) Black Hawk (Buteogallus anthracinus subtilis) in southwestern Ecuador. In: Boletín SAO, Jhrg. 20, Folge 2, 2011 pdf engl.
- J. H. Schnell: Common Black Hawk (Buteogallus anthracinus).In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000; Version 2.0. https://doi.org/10.2173/bna.122 Distribution
- J. H. Schnell: Common Black Hawk (Buteogallus anthracinus). In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000; Version 2.0. https://doi.org/10.2173/bna.122 Demography
- K. E. Etzel, T. C. Theimer, M. J. Johnson, J. A. Holmes: Variation in Prey delivered to Common Black-Hawk (Buteogallus anthracinus) Nests in Arizona Drainage Basins. In: Journal of Raptor Research, Jhrg. 48, Folge 1 2014. S. 54 – 60 pdf engl.
- F. Hiraldo, M. Delibes, J. Bustamante und R. Estrella: Overlap in the Diets of diurnial Raptors breeding at the Michilía Biosphere Reserve, Durango, Mexico. In: The Journal of Raptor Research Jhrg. 25, Folge 2; 1994. Seiten 25 – 29.pdf engl.
- J. H. Schnell: Common Black Hawk (Buteogallus anthracinus). In: The Birds of North America (A. F. Poole and F. B. Gill, Hrsg.). Cornell Lab of Ornithology, Ithaca, NY, USA, 2000; Version 2.0. https://doi.org/10.2173/bna.122 Breeding
- Dr. Jean Cabanis (Hrsg.): Journal für Ornithologie. Band 1-2, Nr. 1-12. Theodor Fischer, Cassel 1853, S. 58 (biodiversitylibrary.org).
- Erwin Stresemann: Ferdinand Deppe's Travels in Mexico (1824 – 1829). In: The Condor, Jhrg. 56, 1954 pdf engl.
- F. Raposo do Amaral, F. H. Sheldon, A. Gamauf †, E. Haring, M. Riesing, L. F. Silveira, und A. Wajntal: Patterns and processes of diversification in a widespread and ecologically diverse avian group, the buteonine hawks (Aves, Accipitridae) In: Molecular Phylogenetics and Evolution Jhrg. 53; 2009; S. 703–715
- Forty-eight Supplement to the American Ornithologists' Union Check-List of North American Birds. In The Auk, Jhrg. 124, Folge 3, 2007. S. 1112 pdf engl.
- Arthur C. Twomey: A new Race of Black Hawk of the Species Buteogallus anthracinus from the Republic of Honduras. In: Annals of the Carnegie Museum. Jhrg. 33,1956. S. 387 – 389. BHL
- William S. Clark: Taxonomic status and distribution of Mangrove Black Hawk Buteogallus (anthracinus) subtilis. In: Bulletin of the British Ornithologists' Club, Jhrg. 127, 2007 S. 110 – 117. BHL
- Burt Leavelle Monroe, Jr: A Distributional Survey of the Birds of Honduras. In: LSU Historical Dissertations and Theses. 1046, 1965. S. 183 – 189. Diss. engl.
- United States Department of Agriculture/Invasive aquatische Neozoen - Northern Crayfish