Rosmarinsäure
Rosmarinsäure ist der Trivialname einer im Pflanzenreich weit verbreiteten Phenylacrylsäure. Chemisch gesehen ist es der Ester der Kaffeesäure mit 3-(3,4-Dihydroxyphenyl)-milchsäure.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Rosmarinsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C18H16O8 | ||||||||||||||||||
| Kurzbeschreibung |
dunkelroter bis brauner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 360,34 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
171–175 °C[1] | ||||||||||||||||||
| Löslichkeit |
etwas in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Die erste Isolierung und Charakterisierung der Rosmarinsäure erfolgte 1958. Sie wurde in diesem Jahr von den beiden italienischen Chemikern M. L. Scarpatti und G. Oriente aus Rosmarin (Rosmarinus officinalis) gewonnen.[3]
Vorkommen
.JPG.webp)
Vor allem die Familien der Lamiaceae, speziell die Unterfamilien Nepetoideae[4] und Boraginaceaen sind reich an Rosmarinsäure. Sie kann aber auch in taxonomisch weiter entfernen Pflanzengruppen, wie Farnen und Hornmoosen, hier jedoch in geringerer Konzentration,[5][6] gefunden werden.
Verwendung
Verwendung in der Pharmazie
Rosmarinsäure besitzt antivirale, antibakterielle und antiinflammatorische Eigenschaften.[7] Sie wird daher in verschiedenen Melissepräparaten eingesetzt,[8] außerdem in einigen Salben gegen Sportverletzungen.
Reine Rosmarinsäure wirkt gegen die komplementabhängige Stimulation der Prostaglandinsynthese,[9] besitzt antioxidative Eigenschaften,[10] blockiert die Opsonisierung[11] und kann leicht über die Haut aufgenommen werden.[12]
Sonstige Verwendung
Rosmarinsäure besitzt, ebenso wie viele andere Phenolcarbonsäureester, gerbende Eigenschaften. Da sie vor allem in Pflanzenarten der Familie Lamiaceen vorkommt, wird sie auch als Lamiaceengerbstoff oder als Labiatengerbstoff – Labiatae ist die veraltete Bezeichnung für Lippenblütler – bezeichnet. In Tierversuchen hatte sie chemoprotektive,[13] neuroprotektive[14] und potentiell antidepressive[15] Wirkungen.
Biologische Bedeutung
Rosmarinsäure ist ein sekundärer Pflanzenstoff. Pflanzen synthetisieren sie als Abwehrstoff gegen Pilze und Bakterien. Außerdem wird vermutet, dass sie die Pflanze vor Fraßfeinden schützt. Pflanzen speichern Rosmarinsäure in den Vakuolen getrennt von Oxidasen. Kommt es zu einer Verletzung, wird diese Kompartimentierung aufgehoben. Die phenolischen Hydroxygruppen der Rosmarinsäure werden zu Orthochinonen oxidiert. Diese binden an Peptide und inaktivieren sie dadurch.[16]
Biosynthese
Die Biosynthese der Rosmarinsäure wurde erstmals 1970 genauer untersucht. Sie beginnt mit den beiden Aminosäuren L-Phenylalanin und L-Tyrosin. Es sind insgesamt acht unterschiedliche Proteine daran beteiligt.
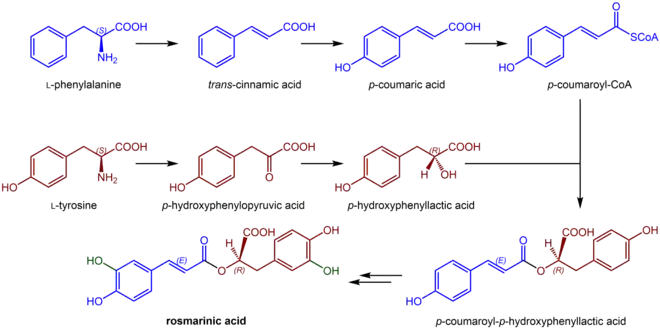
Die Biosynthese lässt sich in drei verschiedene Prozesse untergliedern:
Umsetzung von L-Phenylalanin zu 4-Cumaroyl-CoA
Im ersten Schritt wird Phenylalanin mit Hilfe der Phenylalanin-Ammonium-Lyase (PAL) zu E-Zimtsäure desaminiert. Diese Reaktion ist bei vielen Biosynthesen von Verbindungen mit Phenylpropan-Grundgerüsten zu beobachten. So beginnen auch die Synthesen von Ligninen, Flavonoiden und Cumarinen mit diesem Schritt.
In einem zweiten Schritt wird eine Hydroxygruppe in den aromatischen Ring der E-Zimtsäure eingeführt. Diese Hydroxylierung wird durch das Enzym Zimtsäure-4-Hydroxylase (CAH) katalysiert, es entsteht 4-Cumarsäure. Letztere bildet sich ebenso im Zuge der Desaminierung der Aminosäure L-Tyrosin mit PAL, da dieses Enzym auch diese Aminosäure als Substrat nutzen kann.
Im dritten und letzten Schritt dieses allgemeinen Phenylpropanstoffwechsels konvertiert die 4-Cumarat-CoA-Ligase (4CL) die 4-Cumarsäure in den entsprechenden CoA-Ester.[17]
Umsetzung von L-Tyrosin zu 4-Hydroxyphenyllactat
Parallel zur Umsetzung des L-Phenylalanins erfolgt die Umsetzung von L-Tyrosin. Im ersten Schritt katalysiert die Tyrosin-Aminotransferase (TAT) die Transaminierung mit 2-Oxoglutarat als Aminoakzeptor zu 4-Hydroxyphenylpyruvat und Glutamat. Im zweiten Schritt wird das Pyruvat durch die NADH/NADPH-abhängige Hydroxyphenylpyruvat-Reduktase (HPPR) zum (R)-(+)-4-Hydroxyphenyllactat reduziert.[18]
Umsetzung von 4-Cumaroyl-CoA mit 4-Hydroxyphenyllactat und abschließende Hydroxylierungen
Das Lactat wird durch die Rosmarinsäure-Synthase (RAS) an der aliphatischen Hydroxygruppe mit der im ersten Schritt gebildeten 4-Cumaryl-CoA zum 4-Cumaroyl-4′-hydroxyphenyllactat verestert. Dieser Ester wird in zwei Stufen an den Positionen 3 und 3′ an den aromatischen Ringen hydroxyliert. Katalysiert werden diese Reaktionen durch zwei membrangebundene, Cytochrom-P450-abhängige Hydroxylasen. Dabei entstehen zuerst intermediär Caffeoyl-4′-Hydroxyphenyllactat bzw. 4-Cumaroyl-3′,4′-Dihydroxyphenyllactat und schließlich die Rosmarinsäure.[19]
Literatur
- Ying Ying Gao, Hans-Ullrich Siehl, Heike Petzold, Dieter Sicker, Klaus-Peter Zeller, Prof. Dr. Stefan Berger: Über Rosmarin und Rosmarinsäure: Mittel gegen die Pest und mediterranes Gewürz, in: Chemie in unserer Zeit, Volume 49, Issue 5, pages 302–311, Oktober 2015.
Einzelnachweise
- Datenblatt Rosmarinic acid bei Sigma-Aldrich, abgerufen am 7. Februar 2019 (PDF).
- Abdelkarim Aydi, Carlos Alberto Claumann u. a.: Differential Scanning Calorimetry Data and Solubility of Rosmarinic Acid in Different Pure Solvents and in Binary Mixtures (Methyl Acetate + Water) and (Ethyl Acetate + Water) from 293.2 to 313.2 K. In: Journal of Chemical & Engineering Data. 61, 2016, S. 3718, doi:10.1021/acs.jced.6b00008.
- M. L. Scarpati, G. Oriente: Isolamento e costituzione dell' acido rosmarinico (dal rosmarinus off.). In: Ric.Sci., 28, 1958, S. 2329–2333.
- J. A. Pedersen: Distribution and taxonomic implications of some phenolics in the family Lamiaceae determined by ESR spectroscopy. In: Biochemical Systematics and Ecology, 28, 2000, S. 229–253.
- E. Häusler u. a.: Rosmarinsäure in Blechmum Spezies In: Botanikertagung 1992 Berlin, H. P. Haschek, C. Schnarrenberger (Hrsg.): Akademie Verlag, Berlin, S. 507.
- H. D. Zinsmeister u. a.: Moose, eine Quelle biologisch aktiver Naturstoffe? In: Angewandte Chemie, 103, 1991, S. 134–151.
- M. J. Parnham, K. Kesselring: Rosmarinic acid. In: Drugs of the Future, 10, 1985, S. 756–757.
- G. May, G. Willuhn: Antivirale Wirkung wässriger Pflanzenextrakte in Gewebekulturen. In: Arzneim.Forsch., 28, 1978, S. 1–7.
- M. Rampart u. a.: Complement-dependent stimulation of prostacyclin biosynthesis: Inhibition by rosmarinic acid. In: Biochem. Pharmacol. 35, 1986, S. 1397–1400.
- K. P. Van Kessel u. a.: Rosmarinic acid inhibits external oxydative effects of human polymorphonuclear granulocytes. In: Agent Actions, 17, 1986, S. 375–376.
- A. M. J. J. Verweij-van Vught u. a.: Influence of Rosmarinic acid on opsonization and intracellular killing of Esherishia coli and Staphylococcus aureus by porcine and human polymorphonuclear leucocytes. In: Agents Actions, 22, 1987, S. 288–294.
- W. A. Ritschel u. a.: Percutaneous absorption of rosmarinic acid in the rat. In: Meth. Exp. Clin. Pharmacol., 11, 1989, S. 345–353.
- R Domitrović, I Potočnjak, Z Crnčević-Orlić, M. Skoda: Nephroprotective activities of rosmarinic acid against cisplatin-induced kidney injury in mice. In: Food Chem Toxicol., 8. Februar 2014, PMID 24518541.
- N Braidy, A Matin, F Rossi, M Chinain, D Laurent, GJ. Guillemin: Neuroprotective effects of rosmarinic acid on ciguatoxin in primary human neurons. In: Neurotox Res., 25. Februar 2014, PMID 24097334
- X Jin, P Liu, F Yang, YH Zhang, D. Miao: Rosmarinic acid ameliorates depressive-like behaviors in a rat model of CUS and Up-regulates BDNF levels in the hippocampus and hippocampal-derived astrocytes. In: Neurochem Res., 25. September 2013, PMID 23756732
- E. Häusler, M. Petersen: Isolation of protoplasts and vacuoles from cell suspension cultures of Coleus blumei. In: Benth. Plant Cell Rep., 12, 1993, S. 510–512.
- J. Koukol, E. E. Conn: Metabolism of aromatic compounds in higher plants. In: J. Biol. Chem. 236, 1961, S. 2692–2698.
- M. Petersen, A. W. Alfermann: Two new enzymes of rosmarinic acid biosynthesis from cell cultures of Coleus blumei: hydroxyphenylpyruvate reductase and rosmarinic acid synthase. In: Z. Naturforsch., 43c, 1988, S. 501–504.
- M. Petersen u. a.: Proposed biosynthetic pathway for rosmarinic acid synthase from cell cultures of Coleus blumei. In: Benth. Planta, 189, 1993, S. 10–14.