Raloxifen
Raloxifen (Handelsname Evista; Hersteller Eli Lilly and Company) ist ein Arzneistoff aus der Gruppe der synthetischen, nichtsteroidalen, selektiven Estrogen-Rezeptor-Modulatoren, der in der Behandlung und Prävention der Osteoporose bei postmenopausalen Frauen eingesetzt wird.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
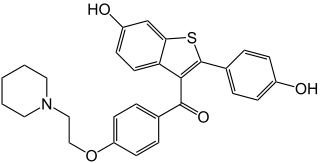 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Raloxifen | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
G03XC01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben
Anwendungsgebiete (Indikationen)
Raloxifen, ein Benzothiophenderivat, wird hauptsächlich in der Prophylaxe und Therapie der postmenopausalen Osteoporose verwendet. Es wurde eine signifikante Verminderung in der Inzidenz von vertebralen Frakturen (in Kombination mit einer Basistherapie aus Ca/VitD), jedoch nicht von Schenkelhalsfrakturen nachgewiesen. Im Gegensatz zur Leitsubstanz Tamoxifen induziert Raloxifen keine Endometriumhyperplasie. Es gibt Hinweise darauf, dass Raloxifen zusätzlich das Brustkrebsrisiko senkt und sich günstig auf das kardiovaskuläre Risiko postmenopausaler Frauen auswirkt.
2018 konnte in einer systematischen Übersichtsarbeit und Metaanalyse nachgewiesen werden, dass Raloxifen bei Schizophrenie – als Zugabe neben der normalen medikamentösen Behandlung – die Symptome spürbar vermindern kann sowie auch über längere Zeiträume angewendet werden kann, und zwar sowohl bei Frauen als auch bei Männern.[3]
Dosierung, Art und Dauer der Anwendung
Die tägliche Dosis beträgt 60 mg Raloxifenhydrochlorid entsprechend 56 mg Raloxifen-Base. Bei älteren Patientinnen ist keine Dosisanpassung notwendig. Gemäß der Natur des Krankheitsverlaufes eignet sich Raloxifen für eine Langzeitbehandlung.[4]
Gegenanzeigen (Kontraindikationen)
Die Anwendung von Raloxifen ist kontraindiziert bei einer Überempfindlichkeit gegenüber dem Wirkstoff; bei Frauen im gebärfähigen Alter; nach einer Lungenembolie und Retina-Venenthrombose; bei schweren Leberfunktionsstörungen inklusive Cholestase (Gallenstauung); venöse thromboembolische Prozesse, in der Anamnese; bei Patientinnen mit tiefen Venenthrombosen; Uterusblutungen unbekannter Genese; bei schweren Nierenfunktionsstörungen; Endometriumkarzinom und Mammakarzinom; es liegen keine Erfahrungen vor in der systemischen Therapie mit Estrogenen.
Wechselwirkungen mit anderen Medikamenten
Bei gleichzeitiger Anwendung von Warfarin oder anderen Cumarinderivaten wurde eine leichte Verkürzung der Prothrombinzeit beobachtet, eine engmaschige Kontrolle ist erforderlich. Raloxifen soll nicht zusammen mit Colestyramin (oder anderen Anionenaustauscher-Harzen) angewendet werden, da diese die Resorption und den enterohepatischen Kreislauf von Raloxifen signifikant vermindern.
Anwendung während der Schwangerschaft und Stillzeit
Klinische Studien beim Menschen und Tierversuche haben eine Schädigung des Fetus gezeigt. Der Arzneistoff ist für schwangere Frauen oder für Frauen, die schwanger werden könnten, kontraindiziert. Es ist ausschließlich die Anwendung bei postmenopausalen Frauen vorgesehen. Im gebärfähigen Alter darf keine Therapie mit Raloxifen durchgeführt werden. Es kann zur Schädigung des Fetus führen, wenn es während der Schwangerschaft verabreicht wird. Sollte dieser Arzneistoff versehentlich während der Schwangerschaft eingenommen oder die Patientin während der Behandlung schwanger werden, ist sie über die Gefahr für den Fetus zu informieren.[4]
Ob Raloxifen in die Muttermilch übergeht, ist nicht bekannt. Die klinische Anwendung während der Stillzeit kann daher nicht empfohlen werden. Es kann zu einer Beeinträchtigung der Entwicklung des Kindes führen.[4]
Unerwünschte Wirkungen (Nebenwirkungen)
Folgende unerwünschte Wirkungen können auftreten:
- Sehr häufig: Hitzewallungen, Nasennebenhöhlenentzündung, Gelenkschmerzen und grippeähnliche Symptome.
- Häufig: Wadenkrämpfe, Wasseransammlungen (Ödeme), Blutbildveränderungen (Thrombozytenverringerung), Rachenentzündungen, Husten, Lungenentzündung, Kehlkopfentzündungen, Muskelschmerzen, Arthritis, Depressionen, Schlaflosigkeit, Gewichtszunahme, Blähungen, Magen-Darm-Entzündungen.
- Gelegentlich: Venenentzündungen mit Venenverschluss (Thrombophlebitiden), Gefäßverschlüsse (Thrombosen), Venenthrombosen, Lungenembolien und Venenthrombosen in der Netzhaut des Auges, Leberwerteerhöhung (AST, ALT).
- Sehr selten: Übelkeit und Erbrechen, Bauchschmerzen, Verdauungsschwäche, Blutdruckerhöhung, Kopfschmerzen, Migräne, Hautausschläge, Brustbeschwerden, Brustschmerzen, Brustvergrößerung, Schmerzempfindlichkeitserhöhung.
- Ohne Angabe: Müdigkeit, Hautausschlag, Herpes simplex, Appetitsteigerung, Schwitzen, und Blasenschwäche (Inkontinenz).[5]
Studien
Raloxifen wurde in der RUTH-Studie (Raloxifen Use for The Heart) auf einen möglichen kardioprotektiven Effekt untersucht. Es ließ sich jedoch kein Effekt auf die Rate der Herzinfarkte, koronar bedingten Todesfälle oder Spitaleinweisungen wegen akuten Koronarsyndroms nachweisen. Allerdings wurde eine erhöhte Anzahl an tödlichen Schlaganfällen beobachtet. Das absolute Risiko für venöse Thromboembolien stieg in der RUTH-Studie um 1,2 pro 1000 Anwenderinnenjahre, dagegen sank die Rate der Brustkrebserkrankungen.[6]
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Selektive Estrogenrezeptor-Modulatoren (SERMs) wie Raloxifen sind Arzneistoffe, welche gewebs- und zellspezifische agonistische und antagonistische Estrogenwirkungen entfalten. Bei Raloxifen liegt die Steroidstruktur des Estrogens nicht vor, jedoch bindet es an die klassischen Estrogenrezeptoren. Aktuell gehört Raloxifen zur 3. Generation dieser Wirkstoffklasse. Raloxifen wirkt an den Estrogenrezeptoren im Knochengewebe agonistisch und entfaltet eine antiresorptive Wirkung, hingegen ist die Wirkung im Brust- oder Endometriumgewebe antagonistisch. Die Bindungsaffinität zu ERα ist vierfach größer als zu ERβ.
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Nach oraler Anwendung wird Raloxifen rasch resorbiert (ungefähr 60 % einer oralen Dosis). Es erfolgt eine charakteristische präsystemische Glucuronidierung. Die absolute Bioverfügbarkeit von Raloxifen beträgt nur 2 %. Die Zeit, bis im Durchschnitt der maximale Plasmaspiegel und die maximale Bioverfügbarkeit erreicht werden, hängt von der systemischen Umwandlung und dem enterohepatischen Kreislauf des Raloxifens und seiner Glucuronid-Metaboliten ab. Raloxifen wird umfassend im Körper verteilt. Das Verteilungsvolumen ist nicht dosisabhängig und die Plasmaproteinbindung beträgt 98–99 %.
Metabolismus und Elimination
Raloxifen unterliegt einem ausgeprägten first-pass-Metabolismus in die entsprechenden Glucuronid-Konjugate: Raloxifen-4'-glucuronid, Raloxifen-6-glucuronid und Raloxifen-6, 4'-diglucuronid. Andere Metaboliten wurden nicht nachgewiesen. Der Anteil von Raloxifen an der Gesamtkonzentration aus Raloxifen und seinen Glucuronidmetaboliten beträgt weniger als 1 %. Die Raloxifenblutspiegel bleiben durch den enterohepatischen Kreislauf erhalten, was zu einer Plasmahalbwertszeit von 27,7 Stunden führt.
Aus den Ergebnissen nach Einzeldosen von Raloxifen lässt sich die Pharmakokinetik nach Mehrfachdosierung ableiten. Höhere Raloxifendosen führen zu einer Vergrößerung der Fläche unter der Plasmakonzentrations-Zeitkurve (AUC), die etwas geringer ausfällt als eine proportionale Vergrößerung. Nach einer oral verabreichten Einzeldosis wird der größte Teil von Raloxifen beziehungsweise seiner Glucuronidmetaboliten innerhalb von 5 Tagen eliminiert und hauptsächlich in den Faeces gefunden, weniger als 6 % werden renal ausgeschieden.[7]
Toxikologie
In einer 8 Wochen dauernden Studie mit 63 postmenopausalen Frauen wurde eine tägliche Dosis von 600 mg Raloxifen·HCl sicher vertragen. In den klinischen Trials gab es keine Raloxifen-Überdosierungen. Seit Markteinführung gibt es spontane Berichte von sehr seltenen Überdosierungen (weniger als 1 von 10.000 (< 0,01 %) behandelten Patientinnen). Die höchste Überdosis betrug ungefähr 1,5 Gramm Raloxifenhydrochlorid, es wurden keine lebensbedrohlichen Zwischenfälle beobachtet. Nach einer einmaligen oralen Dosis bei Ratten und Mäusen von 5 g/kg (810-mal die humane Dosis für Ratten und 405-mal die humane Dosis für Mäuse) traten keine letalen Ausgänge auf. Es gibt kein spezifisches Antidot für Raloxifen.[8]
Chemische- und pharmazeutische Informationen
Arzneilich verwendet wird Raloxifenhydrochlorid mit der Summenformel C28H28ClNO4S, einer molaren Masse von 510,04 g·mol−1, CAS-Nummer = 82640-04-8 und einem Schmelzpunkt von 258 °C. Die Substanz ist sehr schwer löslich in Wasser.[9]
Geschichtliches
Raloxifen wurde vom US-Amerikaner Jones Charles D. erfunden und am 29. November 1983 von Eli Lilly and Company (USA) unter der Patentnummer US 4418068 veröffentlicht.[10]
Literatur
- W. Forth, D. Henschler, W. Rummel: Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. Urban & Fischer, München 2005, ISBN 3-437-42521-8.
- V. Diehl, M. Classen u. a. (Hrsg.): Innere Medizin mit StudentConsult-Zugang. Urban & Fischer in Elsevier, München 2006, ISBN 3-437-44405-0.
Einzelnachweise
- Eintrag zu Raloxifen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- Datenblatt Raloxifene hydrochloride bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- J. de Boer, M. Prikken, W. U. Lei, M. Begemann, I. Sommer: The effect of raloxifene augmentation in men and women with a schizophrenia spectrum disorder: a systematic review and meta-analysis. In: NPJ schizophrenia. Band 4, Nummer 1, Januar 2018, S. 1, doi:10.1038/s41537-017-0043-3, PMID 29321530, PMC 5762671 (freier Volltext) (Review).
- Relistor: Produktinformation, Stand: Januar 2014 auf der Website der Europäischen Arzneimittelagentur.
- Toshinari Takamura, Akiko Shimizu, Takuya Komura, Hitoshi Ando, Yoh Zen, Hiroshi Minato, Eiki Matsushita, Shuichi Kaneko: Selective Estrogen Receptor Modulator Raloxifene-Associated Aggravation of Nonalcoholic Steatohepatitis. In: Internal Medicine. 46(9), 2007, S. 579–581; PMID 17473493; doi:10.2169/internalmedicine.46.6374 PDF (freier Volltextzugriff, engl.)
- FDA Approves New Uses for Evista: Drug Reduces Risk of Invasive Breast Cancer in Postmenopausal Women.
- Evista bei Drugs FDA.
- Full prescribing information for Evista. (PDF; 2,5 MB).
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Inc., Whitehouse Station, NJ, USA 2006.
- Patent US4418068: Antiestrogenic and antiandrugenic benzothiophenes.