Propiolsäure
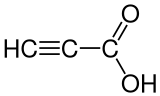
Propiolsäure, auch Acetylencarbonsäure oder Propinsäure genannt, ist eine flüssige, nach Essigsäure riechende ungesättigte organische Säure. Metallsalze (z. B. das Silbersalz) der Verbindung sind explosiv. Die Salze werden allgemein Propiolate genannt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Propiolsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H2O2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 70,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,1325 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| pKS-Wert |
1,94 (25 °C)[4] | ||||||||||||||||||
| Brechungsindex |
1,4315–1,4335[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
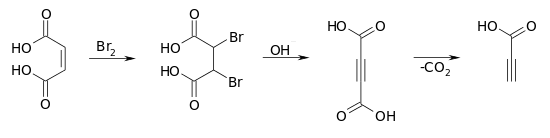
Die Synthese kann von der Maleinsäure ausgehen, wobei zunächst durch eine Bromierung die 2,3-Dibrombernsteinsäure erhalten wird. Eine doppelte Dehydrohalogenierung im basischen Medium führt zur Acetylendicarbonsäure, deren Decarboxylierung die Propiolsäure ergibt.[6]
Propiolsäure kann durch anodische Oxidation von Propargylalkohol hergestellt werden,[7] und wird daher auch Propargylsäure genannt.
Eigenschaften
Physikalische Eigenschaften
Wasserfreie Propiolsäure schmilzt bei 18 °C.[2] Im Phasendiagramm mit Wasser zeigen sich zwei stöchiometrische Hydrate. Das sind ein 1/3-Hydrat mit einem Schmelzpunkt von 10 °C und ein Monohydrat mit einem Schmelzpunkt von −0,3 °C.[2] Zwischen Anhydrat und 1/3-Hydrat, sowie zwischen 1/3-Hydrat und Monohydrat werden eutektische Gemische bei 96 Ma% Propiolsäure mit einer Schmelze bei 7 °C bzw. bei 79 Ma% Propiolsäure mit einer Schmelze bei −0,5 °C beobachtet.[2] Die Verbindung ist stark hygroskopisch. Ein geringer Wassergehalt bewirkt ein signifikantes Absinken des Schmelzpunkts. Propiolsäure ist eine relativ starke Säure. Der pKs-Wert beträgt in Wasser bei 25 °C 1,94[4] und ist vergleichbar mit Hydrogensulfat (pKs 1,92) oder Phosphorsäure (pKs 2,13).
Chemische Eigenschaften
Durch die Umsetzung mit basischem Kupfer(II)-Hydroxid kann das Kupfer(II)-propiolat isoliert werden. Dieses ist nur etwa 24 Stunden stabil und decarboxyliert zu schwarzem, polymerem Kupfer(II)-acetylid.[2] In stark basischem Medium erfolgt eine Redoxreaktion unter Dimerisierung zum Kupfer(I)-Salz der Diacetylendicarbonsäure.[2]
Einzelnachweise
- Eintrag zu Propiolsäure bei ChemBlink, abgerufen am 25. Februar 2011.
- F. Straus, W. Heyn, E. Schwemer: Zur Kenntnis der Propiolsäure in Chem. Ber. 63 (1930), S. 1086–1092; doi:10.1002/cber.19300630513.
- Datenblatt Acetylencarbonsäure (PDF) bei Merck, abgerufen am 22. April 2011.
- C. Laurence, J. Guillemé, B. Kirschleger: Ionization constants of 3-substituted propiolic acids in water in J. Chem. Soc., Perkin Trans. 2, 1981, S. 1341–1343, doi:10.1039/P29810001341.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- W. Lossen: Zur Kenntnis der zweifach gebromten Bernsteinsäuren in Justus Liebigs Annalen der Chemie 272 (1893), S. 127–139, doi:10.1002/jlac.18932720202.
- Eintrag zu Propiolsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
Literatur
- Merck Index. 11th Edition. S. 7833.
- Yasuo Iwanami, Seiko Isoyama, Yoshihisa Kenjo: Die Reaktion von Acetylencarbonsäure mit Aminen. XIII. Substituierte 2-Oxo-3-äthoxycarbonylmethylen-3,4-dihydro-2H-1,4-benzoxazine. In: Bulletin of the Chemical Society of Japan. 37, 1964, S. 1745–1747, doi:10.1246/bcsj.37.1745.


