Photoelektrochemischer Prozess
Photoelektrochemische Prozesse sind Reaktionen und Abläufe in der Photoelektrochemie. Sie transferieren Licht in andere Energieformen.[1] Diese Prozesse spielen in der Photochemie, bei optisch gepumpten Lasern, bei sensibilisierten Solarzellen, bei Lumineszenz und bei der Photochromie eine Rolle.
Elektronische Anregung

Bei einer elektronischen Anregung wird ein Elektron aus einem energetisch niedrigeren Energiezustand wie dem Grundzustand in einen höheren „angeregten Zustand“ überführt. Dies geschieht entweder durch Licht, wobei das Elektron ein Photon absorbiert und die Energie des Photons aufnimmt, oder durch elektronische Anregung, wobei das Elektron die Energie eines anderen Elektrons aufnimmt. Ein anderes Beispiel sind Halbleiter, bei denen durch thermische Anregung Schwingungen angeregt werden (Phononen), die Elektronen in ein höheres Energieniveau, zum Beispiel das Leitungsband, befördern. Wenn ein angeregtes Elektron wieder in einen niedrigeren Energiezustand zurückfällt, wird das Relaxation genannt. Dies geschieht entweder durch Strahlung oder dadurch, dass die Energie an ein anderes Teilchen abgegeben wird.[2]
Photochemische Anregung

Photochemische Anregung ist der Mechanismus der elektronischen Anregung durch Absorption von Photonen, wenn die Energie des Photons zu niedrig ist, um Ionisierung zu verursachen. Die Absorption eines Photons verläuft den Gesetzen der Quantentheorie. Eine Folgereaktion ist beispielsweise die Photoisomerisierung. Man nutzt die photochemische Anregung in der Photochemie, bei farbstoff-sensibilisierten Solarzellen, bei der Lumineszenz, bei optisch gepumpten Lasern und bei Photochromie-Experimenten.
Photoisomerisierung
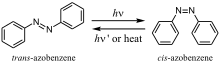
In der Chemie ist Photoisomerisierung die strukturelle Veränderung eines Moleküls, das sich durch Bestrahlung mit Licht in ein anderes Isomer umwandeln lässt, wobei die meisten Isomerisierungen reversibel sind. Photoisomerisierbare Moleküle werden eingesetzt in Pigmenten für überschreibbare CDs, DVDs und optische 3D-Speichermedien. Zusätzlich sind photoisomerisierbare Moleküle interessant als molekulare Schalter,[3] molekulare Motoren,[4] und molekulare Elektronik.
Die wichtigsten Klassen der Photoisomerisierung sind die cis-trans- bzw. (Z)-(E)-Isomerisierung und der Ringschluss-/Ringöffnungsmechanismus. Beispiele sind die Photoisomerisierungen von Stilben und Azobenzol. Diese Arten von Molekülen haben Doppelbindungen und die Rotation um diese Doppelbindung basiert auf der Isomerisierung zwischen zwei Energiezuständen. Beispiele für die cyclischen Moleküle sind Fulgide und Diarylethene: Bei diesem Molekültyp kommt es zur Bindungsspaltung und erneuter Bindungsbildung bei Bestrahlung mit Licht einer spezifischen Wellenlänge. Eine weitere Art von Isomerisierung ist die Di-π-Methan-Umlagerung.
Photoionisierung
Photoionisierung ist ein physikalischer Prozess, bei dem ein Photon ein oder mehrere Elektronen aus einem Atom, Ion oder Molekül herausschlägt. Dies ist im Wesentlichen der gleiche Prozess wie beim Photoeffekt bei Metallen; bei Gasen oder einzelnen Atomen ist der Ausdruck Photoionisierung geläufiger.[5]
Die herausgeschlagenen Elektronen, auch Photoelektronen genannt, enthalten Informationen über den gebundenen Zustand vor der Ionisierung. Ein Photoelektron hat eine kinetische Energie, die der Energie des absorbierten Photons abzüglich der Bindungsenergie entspricht. Photonen mit einer geringeren Energie als der Bindungsenergie können zwar unter Umständen absorbiert werden, können aber das Atom oder Molekül nicht ionisieren.[5]
Um beispielsweise Wasserstoff zu ionisieren, brauchen Photonen eine Energie von mehr als 13,6 eV, was einer Wellenlänge der Photonen von höchstens 91,2 nm entspricht.[6] Die Energie des emittierten Photoelektrons lässt sich durch folgende Gleichung beschreiben:
wobei das Plancksche Wirkungsquantum und die Frequenz des Photons ist.
Für einzelne Photonen mit einer Energie unterhalb der Ionisierungsenergie ist die Photoionisierung gleich null. Mit der Entwicklung von gepulsten Lasern ist es möglich geworden, intensives kohärentes Licht zu erzeugen, wodurch Multiphotonionisierung möglich wird (Absorption mehrerer Photonen). Bei höheren Intensitäten (um 1015–1016 W/cm2) des infraroten oder sichtbaren Lichtbereichs gibt es auch Phänomene wie barrierelose Ionisation.[7][8]
Photohalbleiter
Nach der Erzeugung von Ladungsträgern durch ultraschnelle Lichtblitze bilden sich elektrische Dipole auf Halbleiteroberflächen. Dieses Phänomen wird als Dember-Effekt oder Photo-Dember-Effekt bezeichnet. Die Dipole bilden sich aufgrund der unterschiedlichen Geschwindigkeiten oder Diffusionskonstanten für Elektronen und Löcher in Kombination mit einer Störung der Oberflächensymmetrie, was zu einer effektiven Ladungstrennung senkrecht zur Oberfläche führt.[9]
Grotthuss-Draper Gesetz
Das Grotthuss-Draper-Gesetz (häufig auch Grotthus-Draper-Gesetz geschrieben) besagt, dass nur die elektromagnetische Strahlung photochemisch wirksam sein kann, die von einem System absorbiert wird. Dieses Gesetz bildet die Basis für die Phänomene Fluoreszenz und Phosphoreszenz. Es wurde erstmals 1817 von Theodor Grotthuss und unabhängig von ihm 1842 von John William Draper vorgeschlagen.[5]
Dies ist eins der grundlegenden Gesetze der Photochemie.[5]
Einstein-Stark Gesetz
Das Einstein-Stark-Gesetz[10] ist nach den beiden Physikern Johannes Stark und Albert Einstein benannt, die unabhängig voneinander zwischen 1908 und 1913 dieses Gesetz formulierten. Es ist auch bekannt als Gesetz des photochemischen Gleichgewichts. Vereinfacht sagt es aus, dass jedes Photon, das von einem Körper absorbiert wird, einen chemischen oder physikalischen Prozess auslöst.[11]
Ein Photon ist ein Lichtquant oder eine einzelne Einheit für Strahlung. Daher ist jedes einzelne Lichtquant jeweils ein Vielfaches des Planckschen Wirkungsquantums, multipliziert mit der Lichtfrequenz. Symbole für diese Einheit sind , , oder .
Die Gleichung für dieses photochemische Gesetz lautet wie folgt: jedes Mol einer Substanz, das reagiert, entspricht einem Mol Lichtquanten, die absorbiert werden. In einer Formel ausgedrückt:[11]
wobei die Avogadrokonstante ist.
Dieses Gesetz für das photochemische Gleichgewicht wird angewendet bei lichtinduzierten Reaktionen und bezieht sich auf primäre Prozesse wie Absorption und Fluoreszenz.[11]
Bei den meisten photochemischen Reaktionen folgt dem primären Prozess ein sekundärer photochemischer Prozess, also Folgereaktionen, die kein Licht erfordern. Das bedeutet, dass solche Reaktionen nicht der Ein-Photon-Ein-Molekül-Beziehung entsprechen.[11]
Das Gesetz ist begrenzt auf normale photochemische Prozesse bei Lichtquellen mit mittlerer Intensität; bei Lichtquellen mit hoher Intensität wie bei der Laserflash-Photolyse und bei Laserexperimenten laufen sogenannte Bi-Photonen-Prozesse ab, das bedeutet, Absorption von zwei Photonen.[11]
Absorption
In der Physik ist die Absorption von elektromagnetischer Strahlung die Art und Weise, wie die Energie eines Photons von Materie, typischerweise den Elektronen eines Atoms, aufgenommen wird. Dann kann die elektromagnetische Energie in andere Energieformen, beispielsweise Wärme, umgewandelt werden. Normalerweise hängt die Absorption von Wellen nicht von deren Intensität ab, obwohl unter bestimmten Bedingungen das Medium seine Durchlässigkeit in Abhängigkeit von der Intensität ändert.
Photosensibilisierung
Photosensibilisierung ist ein Prozess, bei dem die Energie des absorbierten Lichts auf andere Moleküle übertragen wird. Nach der Absorption wird die Energie auf einen Reaktanden übertragen. Man nutzt diese Möglichkeit, wenn das für die Reaktion erforderliche Licht nicht in der gewünschten Wellenlänge vorhanden ist, der Sensibilisator jedoch nach Absorption des eingestrahlten Lichts das Licht der erforderlichen Wellenlänge emittieren kann. Sensibilisatoren sind meistens aromatische Verbindungen mit vielen konjugierten Doppelbindungen, sie absorbieren günstigerweise im Bereich des eingestrahlten Lichts (oft im UV-Bereich) und geben Licht im längerwelligen Bereich wieder an andere Moleküle ab.[12]
Sensibilisatoren
Photosensibilisatoren unterscheiden sich in der Absorptionswellenlänge, der Helligkeit und der Emissionsdauer, daher lassen sich für unterschiedliche Reaktionen auch verschiedene Sensibilisatoren verwenden: hier einige Berspiele:
Chemilumineszenz
Wenn Moleküle nach Eintritt einer Reaktion eine Lichtemission zeigen, spricht man von Chemilumineszenz. Die photochemische Anregung erfolgt hierbei durch die chemische Reaktion. Ein gutes Beispiel:
Wenn alkalische Natriumhypochloritlösung mit Wasserstoffperoxid gemischt wird, passiert folgendes:
ist der angeregte Singulettsauerstoff. Dieser Energiezustand ist instabil, wird also unter Emission eines Photons in den Grundzustand zurückfallen.
Es gibt immer mehrere Möglichkeiten der Deaktivierung angeregter Energiezustände:
- strahlungslose Deaktivierung
- Energieübertragung auf ein anderes Molekül wie bei der Photosensibilisierung
- Emission von Licht
Die Intensität, Dauer und Farbe des emittierten Lichtes hängt von mehreren Faktoren, unter anderem von der Struktur der Moleküle und der Kinetik ab.
Fluoreszenzspektroskopie
Fluoreszenzspektroskopie ist eine spektroskopische Analysenmethode, bei der die Fluoreszenz einer Probe analysiert wird. Man verwendet einen Lichtstrahl, normalerweise ultraviolettes Licht, das die Elektronen eines Moleküls zum Schwingen anregt und damit eine Lichtemission niedrigerer Energie (im sichtbaren Bereich) erzeugt. Eine komplementäre Technik ist die Absorptionsspektroskopie.[13][14] Die entsprechenden Messgeräte nennen sich Fluorimeter.
Absorptionsspektroskopie
Absorptionsspektroskopie gehört zu den spektroskopischen Methoden, die die Absorption von Strahlung als eine Funktion der Wellenlänge bzw. der Lichtfrequenz messen, abhängig von den Wechselwirkungen mit einer Probe. Die Probe absorbiert Energie, bzw. Photonen von einer Strahlungsquelle. Die Intensität der Absorption wird als Funktion der Frequenz aufgezeichnet, diese aufgezeichnete Kurve nennt sich Spektrum. Absorptionsspektroskopie kann bei allen Wellenlängen des elektromagnetischen Spektrums durchgeführt werden.[13][14]
Siehe auch
Einzelnachweise
- Heinz Gerischer: Semiconductor electrodes and their interaction with light. In: Mario Schiavello (Hrsg.): Photoelectrochemistry, Photocatalysis and Photoreactors Fundamentals and Developments. Springer, 1985, ISBN 978-90-277-1946-1, S. 39.
- R. P. Madden, K. Codling: Two electron states in Helium. In: Astrophysical Journal. 141, 1965, S. 364. bibcode:1965ApJ...141..364M. doi:10.1086/148132.
- A. Mammana: A Chiroptical Photoswitchable DNA Complex. In: Journal of Physical Chemistry B. 115, Nr. 40, 2011, S. 11581–11587. doi:10.1021/jp205893y.
- J. Vachon: An ultrafast surface-bound photo-active molecular motor. In: Photochemical and Photobiological Sciences. 13, Nr. 2, 2014, S. 241–246. doi:10.1039/C3PP50208B.
- Radiation. In: Encyclopædia Britannica Online. Abgerufen am 9. November 2009.
- B. W. Carroll, D. A. Ostlie: An Introduction to Modern Astrophysics. Addison-Wesley, 2007, ISBN 0-321-44284-9, S. 121.
- N. B. Delone, V. P. Krainov: Tunneling and barrier-suppression ionization of atoms and ions in a laser radiation field. In: Physics-Uspekhi. 41, Nr. 5, 1998, S. 469–485. bibcode:1998PhyU...41..469D. doi:10.1070/PU1998v041n05ABEH000393.
- : Cross-shell multielectron ionization of xenon by an ultrastrong laser field. In: Proceedings of the Quantum Electronics and Laser Science Conference . Optical Society of America, S. 1974–1976. ISBN 1-55752-796-2 doi:10.1109/QELS.2005.1549346
- T. Dekorsy: THz electromagnetic emission by coherent infrared-active phonons. In: Physical Review B. 53, Nr. 7, 1996, S. 4005. bibcode:1996PhRvB..53.4005D. doi:10.1103/PhysRevB.53.4005.
- Einstein-Stark Gesetz, Spektrum Lexikon der Physik
- Photochemical equivalence law. In: Encyclopædia Britannica Online. Abgerufen am 7. November 2009.
- Photosensitization. In: Encyclopædia Britannica Online. Abgerufen am 10. November 2009.
- Hollas: Modern Spectroscopy, 4th. Auflage, John Wiley & Sons, 2004, ISBN 0-470-84416-7.
- D. C. Harris, M. D. Bertolucci: Symmetry and Spectroscopy: An introduction to vibrational and electronic spectroscopy, Reprint. Auflage, Dover Publications, 1978, ISBN 0-486-66144-X.