Rubren
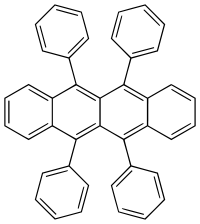
Rubren (5,6,11,12-Tetraphenylnaphthacen) ist ein roter polycyclischer aromatischer Kohlenwasserstoff, welcher unter anderem in Leuchtstäben als Fluoreszenzfarbstoff eingesetzt wird. Als Folge der Chemolumineszenz emittiert er in diesem Fall gelbes Licht.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Rubren | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C42H28 | |||||||||||||||
| Kurzbeschreibung |
rotes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 532,67 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Rubren ist ein organischer Halbleiter und dient als Ausgangsmaterial für die Herstellung von organischen Leuchtdioden (OLED) und organischen Feldeffekttransistoren. Rubren weist mit 40 cm2/(V·s) die höchste Ladungsträgerbeweglichkeit für Defektelektronen unter den organischen Halbleitern auf.[3] Die hohen Beweglichkeiten werden jedoch nur in perfekt ausgebildeten Rubren-Kristallen erreicht.[4] In durch thermisches Verdampfen oder aus Lösung (spin coating, Druckprozesse) prozessierten Schichten zeigt Rubren um ein bis zwei Größenordnungen geringere Beweglichkeiten und ist somit für Arbeiten an organischen Feldeffekttransistoren weitgehend durch andere halbleitende Materialien, z. B. substituierte Acene,[5] verdrängt worden.[4][6]
 5,6,11,12-Tetraphenylnaphthacen in Pulverform
5,6,11,12-Tetraphenylnaphthacen in Pulverform
Synthesen

Rubren ist aus dem Addukt von Phenylacetylen an Benzophenon durch Behandlung mit Thionylchlorid zugänglich (vgl. nebenstehendes Schema).[7][8] Eine präparative Vorschrift für diese Route hat Einzug in die Lehrbuchliteratur gefunden.[9] Zum mechanistischen Ablauf der Reaktion wurde lange angenommen, dass zunächst eine Diels-Alder-Reaktion zwischen zwei der intermediär gebildeten Chlor-triphenyl-allene stattfindet (Einbeziehung eines Benzolringes unter Verlust der Aromatizität, Strukturelemente im nebenstehenden Schema fett hervorgehoben).[9][10][11] Ein verbessertes Verständnis der Dimerisierung von Allenen lässt jedoch erwarten, dass die Dimerisierung radikalisch über ein bis-Allyl-Diradikal verläuft.[12][13] Entsprechende Untersuchungen wurden von Papagni und Yassar et al. veröffentlicht.[14] Hiernach cyclisiert das intermediäre Diradikal unter Einbeziehung eines Benzolringes, gefolgt von HCl-Abspaltung unter Rearomatisierung. Im gebildeten Naphthalinderivat liegen günstige stereoelektronische Bedingungen für einen 1,6-elektrocyclischen Ringschluss vor, wiederum gefolgt von HCl-Abspaltung unter Aromatisierung.
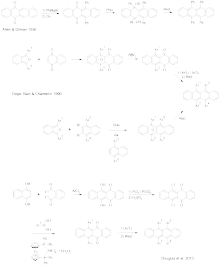
Zugang zu Rubren-Derivaten mit unterschiedlichen Arylsubstituenten am Tetracengerüst sind u. a. auf den von Allen und Gilman,[10] Dodge, Bain und Chamberlin[15] sowie Douglas et al.[16] beschriebenen Routen zugänglich (vgl. nebenstehendes Schema). Bei ihren Zugängen nutzen Allen und Gilman die konjugierte Addition von Aryl-Grignard-Reagenzien an Tetracen-5,12-dion sowie die Addition von Aryl-Li-Verbindungen an die Keto-Gruppen von Tetracen-5,12-dion. Die beiden Varianten von Dodge, Bain und Chamberlin basieren auf dem Aufbau der Tetracenstruktur durch Diels-Alder-Reaktionen von Isobenzofuranen. Douglas et al. schließlich funktionalisieren 6,11-Dichlor-tetracen-5,12-dion gezielt durch Suzuki-Kupplung mit Boronsäuren, gefolgt von der Addition von Aryl-Li-Reagenzien an die Keto-Gruppen des Tetracendions.
Einzelnachweise
- Datenblatt Rubrene, sublimed grade, 99.99 % trace metals basis bei Sigma-Aldrich, abgerufen am 8. August 2011 (PDF).
- Eintrag zu 5,6,11,12-Tetraphenylnaphthacen bei ChemicalBook, abgerufen am 7. August 2011.
- Tatsuo Hasegawa and Jun Takeya: Organic field-effect transistors using single crystals. (free download review) In: Sci. Technol. Adv. Mater.. 10, Nr. 2, 2009, S. 024314. bibcode:2009STAdM..10b4314H. doi:10.1088/1468-6996/10/2/024314.
- John E. Anthony: Functionalized Acenes and Heteroacenes for Organic Electronics. In: Chemical Reviews. 106, Nr. 12, 2006, S. 5028–5048, doi:10.1021/cr050966z.
- John E. Anthony: The Larger Acenes: Versatile Organic Semiconductors. In: Angewandte Chemie International Edition. 47, Nr. 3, 2008, S. 452–483, doi:10.1002/anie.200604045.
- Sybille Allard, Michael Forster, Benjamin Souharce, Heiko Thiem, Ullrich Scherf: Organic Semiconductors for Solution-Processable Field-Effect Transistors (OFETs). In: Angewandte Chemie International Edition. 47, Nr. 22, 2008, S. 4070–4098, doi:10.1002/anie.200701920.
- Erste Arbeiten: Charles Dufraisse, Bulletin de la Société chimique de France, 4e sér. 53, 1933, S. 789–849.
- Georg Wittig, Dieter Waldi: Über eine vereinfachte Darstellung von Rubren. In: Journal für Praktische Chemie. 160, Nr. 8–9, 1942, S. 242–244, doi:10.1002/prac.19421600802.
- B. S. Furniss, A. J. Hannaford, P. W. G. Smith, A. R. Tatchell (Hrsg.): Vogel’s Textbook of Practical Organic Chemistry. 5. Auflage, Longman Scientific & Technical, 1989, ISBN 0-582-46236-3, Kapitel 6.1.4, Versuch 6.13 (Online-Zugang).
- C. F. H. Allen, L. Gilman: A Synthesis of Rubrene. In: Journal of the American Chemical Society. 58, Nr. 6, 1936, S. 937–940, doi:10.1021/ja01297a028. Die Diels-Alder-Reaktion wird hier noch als "Dien-Synthese" bezeichnet.
- L. F. Fieser, M. Fieser: Organische Chemie.2., verbesserte Auflage, Verlag Chemie, Weinheim 1982, S. 1384.
- Joseph J. Gajewski, Chung Nan Shih: Hydrocarbon Thermal Degenerate Rearrangements. V. Stereochemistry of the 1,2-Dimethylenecyclobutane Self-Interconversion and Its Relation to the Allene Dimerization and the Rearrangements of Other C6H8 Isomers. In: Journal of the American Chemical Society. 94, Nr. 5, 1972, S. 1675–1682, doi:10.1021/ja00760a041.
- Sarah L. Skraba, Richard P. Johnson: A Computational Model for the Dimerization of Allene. In: The Journal of Organic Chemistry. 77, Nr. 24, 2012, S. 11096–11100, doi:10.1021/jo302176k.
- Daniele Braga, Abdelhafid Jaafari, Luciano Miozzo, Massimo Moret, Silvia Rizzato, Antonio Papagni, Abderrahim Yassar: The Rubrenic Synthesis: The Delicate Equilibrium between Tetracene and Cyclobutene. In: European Journal of Organic Chemistry. 2011, Nr. 22, 2011, S. 4160–4169, doi:10.1002/ejoc.201100033.
- Daniele Braga, Abdelhafid Jaafari, Luciano Miozzo, Massimo Moret, Silvia Rizzato, Antonio Papagni, Abderrahim Yassar: The Rubrenic Synthesis: The Delicate Equilibrium between Tetracene and Cyclobutene. In: European Journal of Organic Chemistry. 2011, Nr. 22, 2011, S. 4160–4169, doi:10.1002/ejoc.201100033.
- Kathryn A. McGarry, Wei Xie, Christopher Sutton, Chad Risko, Yanfei Wu, Victor G. Young, Jean-Luc Brédas, C. Daniel Frisbie, Christopher J. Douglas: Rubrene-Based Single-Crystal Organic Semiconductors: Synthesis, Electronic Structure, and Charge-Transport Properties. In: Chemistry of Materials. 25, Nr. 11, 2013, S. 2254–2263, doi:10.1021/cm400736s.