Photochromie
Unter Photochromie versteht man die lichtinduzierte reversible Umwandlung zweier Spezies ineinander unter Änderung des Absorptionsspektrums sowie damit einhergehend ihrer physikalischen Eigenschaften. Die Rückreaktion kann dabei thermisch (T-Typ-Photochromie) oder ebenfalls photochemisch (P-Typ-Photochromie) ablaufen. Im thermischen Fall wird das System unter der Bedingung, dass A stabiler ist als B, nach Entfernen der anregenden Strahlungsquelle bei Standardbedingungen spontan in den Zustand A zurückkehren. Bei P-Typ-Photochromie wird die Rückreaktion unter Bestrahlung mit einer Wellenlänge ν2 stark beschleunigt.
- A ↔ B
Diese Reversibilität unterscheidet Photochromie von den wohlbekannten lichtinduzierten Reaktionen. Zeigt das System unter Einwirkung der elektromagnetischen Strahlung eine Erhöhung der Farbigkeit, so spricht man von positiver, im umgekehrten Fall von negativer Photochromie. In der Realität treten allerdings oftmals Folge- und Nebenreaktionen auf, die die Haltbarkeit der photochromen Materialien begrenzen und das Schema verkomplizieren.
Photochromie kommt auch bei natürlich gebildeten Substanzen wie beispielsweise den positiv photochromen Mineralen Kleinit und Tugtupit sowie der je nach Fundort negativ oder positiv photochromen Sodalith-Varietät Hackmanit.
Gated Photochromie
Unter gated photochromism versteht man die Abhängigkeit einer photochromen Reaktion von einem hemmenden Faktor. Die photochrome Reaktion findet nicht statt, solange nicht ein externer Stimulus (z. B. Elektrizität, Photonen einer anderen Wellenlänge, Hitze, chemische Aktivierung) erfolgt. Schon länger bekannt sind photochrome Saccharidsensoren.[1] Das Beispiel in Abb. 1 zeigt ein neuartiges dienophilabhängiges Sensormolekül, das einmal Anwendungen in chemischen Dosimetern finden könnte.[2]
Dual-Modus-Photochromie
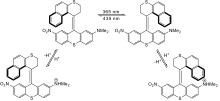
Unter Dual-Modus-Photochromie versteht man Systeme, die durch mehr als einen externen Stimulus beeinflusst werden können. Huck et al. stellten 1995 einen chirooptischen molekularen Schalter vor, der es erlaubt, den photochemisch eingestellten Zustand chemisch durch Zurverfügungstellung von Protonen zu sichern, da die protonierten Spezies nicht mehr photoaktiv sind.[3]
Geschichte
Den Begriff Photochromie prägte Hirshberg[4] 1950, die Beobachtung photochromer Phänomene wurde allerdings bereits von Fritzsche[5] 1867 beschrieben, der das Ausbleichen einer Lösung von orangefarbigem Tetracen während des Tages und die Rückkehr der Farbe in der Nacht beobachtete. Weitere frühe Meilensteine der Photochromie wurden von ter Meer[6] und Markwald gesetzt. Ersterer entdeckte die reversible Färbung von mit einem Zinkpigment bestrichenen Zaunpfählen im Sonnenlicht, Letzterer untersuchte den Farbwechsel von 2,3,4,4-Tetrachlornaphthalin-1(4H)-on in kristalliner Form. Erst ab 1940 gelangte das Thema wieder in das Blickfeld der Forschung, als Hirshberg und Fischer am Daniel-Sieff-Forschungs-Institut in Rechowot, Israel, systematische Versuche unternahmen, um Synthesewege und Mechanismen photochromer Verbindungen aufzuklären. In den 1960er-Jahren folgte die Entwicklung des Gebietes, vor allem der physikalischen Methoden, auf denen es aufbaute. Ungelöste Probleme der damals bekannten photochromen Verbindungsklassen, vor allem die eminente Photozersetzung, ließen die Forschung stagnieren, bevor in den 1980er-Jahren die ersten ermüdungsfreien Chromen- und Spirooxazinverbindungen gezeigt werden konnten. Der Zuspruch zu diesem Forschungsgebiet ist seither groß, die Anzahl der Veröffentlichungen ist stetig gestiegen, Reviews sind erschienen,[7] und sogar der Bundestag nahm in Form einer Technikfolgenabschätzung zur Nanotechnologie Notiz.[8]
Anregungsmechanismen
Im Allgemeinen kann davon ausgegangen werden, dass die Bildung der Spezies B nach einem Ein-Photonen-Mechanismus ausgehend von der Anregung des Moleküls in einen Singulett- oder Triplettzustand erfolgt. Für Anwendungen wie dreidimensionale optische Speichermedien besonders interessant sind jedoch Systeme, die auf Zwei-Photonen-Mechanismen beruhen. Hier kann, wie in Abb. 3 gezeigt, die Anregung durch zwei verschiedene Wellenlängen ν1 und ν2 erfolgen. Dabei erfolgt die Absorption entweder simultan über ein virtuelles Niveau oder sequentiell über ein reales Niveau, von dem aus die Anregung in das höhere Niveau Sn erfolgt. Außerdem besteht die Möglichkeit der Führung des photochromen Mechanismus über ein instabiles Intermediat, dass nach Absorption eines zweiten Photons der gleichen Wellenlänge zum Produkt B weiterreagiert. Da die Anregungswahrscheinlichkeit vom Produkt der Photonendichten Ep(1) und Ep(2) abhängt, ist die Verwendung von ultrakurzen Laserpulsen im Femtosekundenbereich vorteilhaft.
Verbindungsklassen und Mechanismen
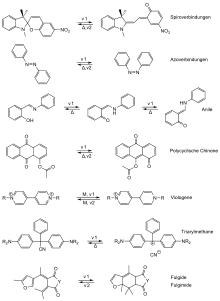
Heute sind eine Vielzahl von Verbindungsklassen bekannt, die jeweils ihre eigenen photochromen Reaktionen eingehen. Die wichtigsten sind in Abb. 4 anhand ihrer Isomerisierungsreaktionen gezeigt. So zeigen Spiropyrane, Spirooxazine, Chromene, Hexa-1,3,5-triene, Diheteroarylethene und Cyclohex-1,3-diene Elektrocyclisierungen unter Beteiligung von sechs π-Elektronen und sechs Atomen bzw. im Fall der Pyrazoline fünf Atomen. Die lichtinduzierte E/Z-Isomerisierung von Stilben, der Azoverbindungen, Azine oder Thioindigo-Typ-Verbindungen ist wohlbekannt und wird in Modellsystemen genutzt, um Moleküle an ihren Wirkort zu bringen und gerichtet freizusetzen.[9] Andere Mechanismen basieren auf dem intramolekularen Transfer von Protonen (Anile, Benzylpyridine, Acinitroverbindungen, Salicylate, Triazole, Oxazole, Metalldithizonate und Perimidinspirohexadienone) oder größeren Gruppen z. B. Acetylgruppen bei polycyclischen Chinonen (Abb. 4). Außerdem sind heterolytische Bindungsspaltungen von Triarylmethanen und homolytische bei Triarylimidazoldimeren, Tetrachlornaphthalinen, Perchlortoluol, Nitrosodimeren und Hydrazinen bekannt. Bei Viologenen findet man Elektronentransferreaktionen. Die Phytochromie und Phototropie beruhen ebenfalls auf photochrome Reaktionen.
Anwendungen
Die Anwendungsmöglichkeiten photochromer Verbindungen beruhen zum größten Teil auf einigen Kennziffern, von denen die wesentlichen hier erläutert werden sollen.
- Die Färbbarkeit beschreibt die Fähigkeit eines Systems, Farbe zu entwickeln. Die Anfangsabsorption A0 ist bei der Bestrahlung mit Licht der Wellenlänge λ proportional zur Quantenausbeute der Photoreaktion Φ, dem molaren Absorptionskoeffizienten der gefärbten Form Q, der Konzentration der farblosen Form und dem Photonenfluss (in k enthalten). A0(λ)=k·Φ·Q·c
- Unter Ermüdung versteht man den durch Nebenreaktionen (v. a. photochemisch aktivierte Oxidationsreaktionen) entstehenden Effizienzverlust der photochromen Reaktion.
- Unter der Zyklenzahl bzw. dem Z50-Wert versteht man die Zahl von Ein- und Ausschaltvorgängen (Umwandlung A → B → A) innerhalb eines Systems nach denen noch 50 % der anfänglichen Absorption vorhanden sind. Besonders stabile Verbindungen wie das später noch eingehender besprochene Bacteriorhodopsin überleben 100.000 Zyklen ohne Zersetzung.
- Die Halbwertszeit kennzeichnet in der Photochromie die Zeit, die das System benötigt, damit der Absorptionswert durch thermisches Ausbleichen wieder auf die Hälfte des maximalen Wertes innerhalb eines Zyklus zurückgeht.
Die bereits erwähnten mit der Photochromie einhergehenden Änderungen direkt beobachtbarer physikalischer Eigenschaften wie Lumineszenz, elektrischer Widerstand, Brechungsindex, Zirkulardichroismus und Viskosität versprechen einschneidende Verbesserungen in der Optoelektronik und den Materialwissenschaften. Besonders im Bereich der optischen Datenspeicherung versprechen photochrome Systeme im Vergleich den bisherigen thermo- oder magnetooptischen Verfahren erhebliche Vorteile. Allerdings erfüllen nicht alle in Lösung photochromen Substanzen die nötigen Kriterien, auch in fester Phase keine Nebenreaktionen einzugehen, aber trotzdem wie gewünscht reagieren zu können.
Sonnenbrillen
Das klassische Beispiel für photochrome Systeme sind sicherlich die von Armistead 1962 erfundenen[10] und von Corning Glass Works unter dem Handelsnamen BestliteTM vermarkteten silberhalogenidhaltigen Sonnenbrillengläser. Trotz Nachteilen in der Haltbarkeit haben Kunststoffmaterialien herkömmliche Glaslinsen aufgrund Gewichtsvorteilen fast völlig verdrängt. Heutige Brillenmaterialien basieren meist auf dem Standardpolymer CR 39 (Polyallyldiglycolcarbonat), das durch Polymerisation von Allyl-diglycol-carbonat (ADC) hergestellt wird. Zur Einführung der photochromen Eigenschaften kann entweder die Funktionalität mit einer zusätzlich härtenden anorganischen Beschichtung eingeführt oder direkt in die Matrix eingebaut werden. Letzteres bietet Vorteile in der Haltbarkeit, macht den Herstellungsprozess aber aufwendiger und teuer.[11]
Binnen Umschaltzeiten von 0,01 bis 0,1 Sekunden abdunkelnde Automatik-Schweißschutzschirme und Sportbrillen[12] für Fahrten über Strecken mit unbeleuchteten Straßentunnel basieren hingegen auf elektrisch angesteuerter Flüssigkristalltechnik.
Optische Speicher auf Basis von Spiropyranen

1989 wurde in einer vielbeachteten Publikation[13] erstmals die Realisierung eines dreidimensionalen Speichersystems auf Spiropyranbasis gezeigt. Das berechnete optische Limit der Datendichte beträgt für λ = 517 nm ca. 812 GB/cm³ und liegt damit ungefähr um den Faktor 1000 über dem einer zweilagigen DVD. In Abb. 5 ist gezeigt, wie der geteilte und zur Hälfte frequenzverdoppelte Strahl eines Nd:YAG-Lasers eingesetzt wird, um ortsspezifisch Daten in ein dreidimensionales Medium zu schreiben, in das ein photochromes Spiropyran eingeschlossen ist. Von Nachteil ist allerdings die im Vergleich zu Chromenen, Spiroxazinen und Bakteriorhodopsin geringe Zyklenzahl, die dieses System übersteht. Dennoch wurde an diesem Beispiel erstmals dokumentiert, wie sich in einem Zwei-Photonenprozess Daten schreiben, per Fluoreszenz auslesen und selektiv wieder löschen lassen.
Bacteriorhodopsin
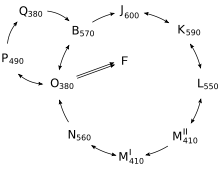
So eignet sich z. B. das umfassend erforschte Bacteriorhodopsin (BR), das im Halobacterium salinarium vorkommt und dort als lichtgetriebene Protonenpumpe dient, zur Speicherung großer Mengen von Daten in kleinen Volumen. Unter Ausnutzung der photochemischen Anregung vom O-Intermediat des BR-Photozyklus in den im Zustand 9-cis-Retinal enthaltenden Zustand P und dessen thermische Umwandlung in Q, der seinerseits photochemisch in den B-Grundzustand überführt werden kann, ist beliebiges Schreiben und Löschen von Daten innerhalb des Mediums möglich. Prozessverbesserungen der biotechnologischen Synthese des BR führten zu sinkenden Preisen, die BR nun für neue Anwendungen attraktiv erscheinen lassen. Trotzdem liegen die Preise derzeit weiterhin im zweistelligen Dollarbereich pro Gramm. Eine Anwendung zur verschlüsselten optischen Speicherung sicherheitskritischer Daten in einem WORM-Verfahren wurde an der Universität Marburg gezeigt.[14] Abseits des bekannten Photozyklus kann durch Zwei-Photonenabsorption ein thermisch und photochemisch stabiler Zustand erreicht werden (sog. F-Zustand), dessen persistente Polarisation durch die Modulation der Polarisation des Neodym-Lasers festgelegt werden kann. Die Verschlüsselung erfolgt entweder simultan oder sequentiell durch Überschreiben der Nutzdaten mit Daten des Schlüssels, hier eines one-time-pads. Zum Auslesen der Daten ist nur eine vertikal polarisierte Lichtquelle und ein drehbarer Polarisationsfilter für die Optik der CCD-Kamera nötig. Die erzielbare Datendichte blieb in der zitierten Literatur durch den Wunsch nach der Verwendung günstiger Kunststoffoptiken auf ca. 125 KB/cm[2] begrenzt. 1993 zeigten Popp et al. die zweidimensionale[15] und Birge et al. 1994 die dreidimensionale[16] holographische Datenspeicherung in BR-haltigen Materialien.
Foldamere
Foldameren[17] wird nach aktuellem Stand der Forschung großes Potential im Bereich der drug delivery und der photoadaptiven intelligenten Materialien zugeschrieben. Schon länger ist bekannt, dass Foldamere in Lösung stabile helicale Strukturen einnehmen können. Khan et al. gelang es nun erstmals durch Einbau einer Diazogruppe in der Mitte des Polyphenylenethinylenrückrats des Foldamers, ein photoschaltbares Foldamer vorzustellen. Befindet sich die Diazobindung in E-Konfiguration, wird die Struktur empfindlich gestört, die Helix entfaltet sich und evtl. eingeschlossene Moleküle werden freigesetzt.[9]
Siehe auch
Literatur
- Ernst Fischer: Photochromie und photochrome Verbindungen, Chemie in unserer Zeit, 9. Jahrg. 1975, Nr. 3, S. 85–95, ISSN 0009-2851
- Heinz Durr (Herausgeber), Henri Bouas-Laurent (Herausgeber): Photochromism: Molecules and Systems. Elsevier Science Ltd, revised ed. 2003, ISBN 978-0-444-51322-9
Einzelnachweise
- Michinori Takeshita, Kingo Uchida, Masahiro Irie: Novel saccharide tweezers with a diarylethene photoswitch. In: Chemical Communications. Band 1996, Nr. 15, 1996, S. 1807–1808.
- Vincent Lemieux, Neil R. Branda: Reactivity-gated photochromism of 1,2-dithienylethenes for potential use in dosimetry applications. In: Org. Lett. Band 7, Nr. 14, 2005, S. 2969–2972.
- Nina P. M. Huck, Ben L. Feringa: Dual-mode photoswitching of luminescence. In: Journal of the Chemical Society, Chemical Communications. Band 1995, Nr. 11, 1995, S. 1095–1096.
- Yehuda Hirshberg: Photochromie dans la serie de la bianthrone. In: Comptes Rendus de l’Academie des Sciences. Band 231, Nr. 903, 1950.
- J. Fritzsche: Note sur les carbures d’hydrogène solides, tirés du gaudron de houille. In: Comptes Rendus de l’Académie des Sciences. Band 69, 1867, S. 1035–1037.
- Edm. ter Meer: Ueber Dinitroverbindungen der Fettreihe. In: Justus Liebig’s Annalen der Chemie. Band 181, Nr. 1, 1876, S. 1–22, doi:10.1002/jlac.18761810102.
- Heinz Duerr: Organische Photochromie. In: Angewandte Chemie. Band 116, Nr. 25, 2004, S. 3404–3418.
- H. Paschen, C. Coenen, T. Fleischer, R. Grünwald, D. Oertel: TA-Projekt Nanotechnologie. In: Büro für Technikfolgenabschätzung des Deutschen Bundestages (Hrsg.): Endbericht (TAB-Arbeitsberichte 92). Bonn 2003.
- Anzar Khan, Christian Kaiser, Stefan Hecht: Prototyp eines photoschaltbaren Foldamers. Angewandte Chemie, 118(12):1912–1915, 2006.
- William H. Armistead, Stanley D. Stookey: Phototrophic Material And Article Made Therefrom. U.S. Patent 3,208,860, July 1962
- Hybridpolymere Schichtsysteme. (Memento des Originals vom 21. September 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Fraunhofer Institut für Silicatforschung
- Archivierte Kopie (Memento des Originals vom 24. Juli 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Ctrl Eyewear > Specs, © 2015, abgerufen 24. Juli 2016.
- Dimitri A. Parthenopoulos, Peter M. Rentzepis: Three-Dimensional Optical-Storage Memory. Science, 245:843–845, 1989
- Thorsten Fischer, Martin Neebe, Thorsten Juchem, Norbert A. Hampp: Biomolecular Optical Data Storage and Data Encryption. IEEE Transactions on Nanobioscience, 2:1–5, 2003
- A. Popp, M. Wolperdinger, N. Hampp, C. Bruchle, D. Oesterhelt: Photochemical conversion of the O-intermediate to 9-cis-retinal-containing products in bacteriorhodopsin films. In: Biophysical Journal. Band 65, Nr. 4, 1993, S. 1449–1459.
- Robert R. Birge: Branched photocycle optical memory device. U.S. Patent 5,559,732, 1994
- David J. Hill, Matthew J. Mio, Ryan B. Prince, Thomas S. Hughes, Jeffrey S. Moore: A field guide to foldamers. In: Chem. Rev. Band 101, Nr. 12, 2001, S. 3893–4012.