Phenmetrazin
Phenmetrazin ist eine chemische Verbindung aus der Gruppe der Amphetamine und der Morpholine. Es wurde früher als Appetitzügler verwendet, ist jedoch nicht mehr erhältlich. Daneben wurde es wegen seiner stimulierenden Wirkung als Droge verwendet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
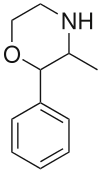 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Phenmetrazin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C11H15NO | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 177,25 g·mol−1 | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Phenmetrazin gehört zu den Sympathomimetika und wirkt auf das zentrale Nervensystem. Als solches dämpft es im Gehirn das Appetit- und Hungergefühl und aktiviert indirekt die Sympathikusaktivität, wodurch es unter anderem zu erhöhter Wachheit und verringertem Schlafbedürfnis sowie gesteigerter körperlicher und geistiger Ausdauer kommt.[4] Durch die euphorisierende Wirkung besteht die Gefahr der Entwicklung einer Abhängigkeit. Phenmetrazin (inkl. seiner Salze) ist in Deutschland als verkehrsfähiges, nicht verschreibungsfähiges Betäubungsmittel (Anlage II zum Betäubungsmittelgesetz) geregelt. Pharmazeutisch verwendet wurde die Substanz als Phenmetrazinhydrochlorid,[5] eine kristalline Substanz, die bei 182 °C schmilzt und zu 1 g in 0,4 ml Wasser löslich ist.[2] Als weiteres Salz ist das des 8-Chlortheophyllins beschrieben, Phenmetrazinteoclat.[6]
3-Methyl-2-phenylmorpholin hat zwei chirale C-Atome, so dass vier Isomere möglich sind. Phenmetrazin wurde als die racemische trans-Form beschrieben.[7][8]
Entwicklungsgeschichte
Phenmetrazin wurde 1958 von Boehringer Ingelheim patentiert.[1][9][10] Im Jahr 1954 wurden pharmakologische Eigenschaften beschrieben.[11] Ziel der Entwicklung war ein Appetitzügler ohne die typischen Nebenwirkungen der Amphetamine.[12] Klinische Studien wurden 1954 in Europa durchgeführt.[13]
In Deutschland kamen Phenmetrazin-Tabletten 1954 nach einjähriger Testung als Preludin zur „Behandlung von Fettleibigkeit“ auf den Markt,[14][15] bereits ein halbes Jahr nach Markteinführung erfuhren die Hersteller vom Gebrauch in Laienkreisen zur Bekämpfung von Ermüdungserscheinungen. 1955 wurde in Deutschland die Rezeptpflicht für das Mittel eingeführt, einige Staaten regelten Phenmetrazin 1966 wegen der Suchtgefahr schon betäubungsmittelrechtlich.[15] Auch in Deutschland wurde Phenmetrazin später als Betäubungsmittel eingestuft, bevor es wegen lebensbedrohlicher pulmonaler Hypertonien[16] in den 1970er Jahren[17] vom Markt genommen wurde.
Synthese
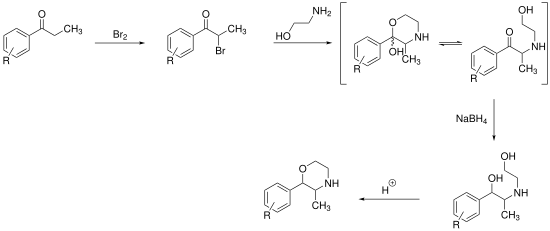
Es werden Synthesen für Phenmetrazin und seine Derivate beschrieben.[18][19] Sie gehen von Propiophenon aus, welches im ersten Schritt mit Brom am α-Kohlenstoff bromiert wird. Es folgt die Umsetzung mit Monoethanolamin. Das Produkt dieser Reaktion kann als Halbacetal oder als offenkettige Verbindung vorliegen. Letztere kann durch Natriumborhydrid zum Diol reduziert werden. Säurekatalysierte Cyclisierung führt zur Bildung des Morpholin-Rings.
Wirkung
Im Vergleich zu anderen Amphetaminen erzeugt Phenmetrazin weniger Nervosität, Erregbarkeit, Euphorie, Schlaflosigkeit[20] und eine Verlangsamung der Pulsrate bei Übergewichtigen. In einer Studie wurde es von übergewichtigen Kindern bei einer zweimal täglichen Einnahme von einer halben Tablette gut vertragen, sodass deren Appetit stark zurückging sowie durch das wachsende Bedürfnis nach körperlicher Aktivität die körperliche Leistungsfähigkeit anstieg.[12] In einer Studie zum Vergleich von Phenmetrazin und Dextroamphetamin wurde bei Phenmetrazin eine geringfügig höhere Wirksamkeit zur Gewichtsminderung festgestellt.[21]
Phenmetrazin verstärkt die Freisetzung von Norepinephrin und Dopamin mit einer EC50 von 50,4 ± 5,4 nM bzw. 131 ± 11 nM.[22] Die Wirkung auf die Freisetzung von Serotonin ist vernachlässigbar bei einer EC50 von 7,765 ± 610 nM.[22] Nach oraler Einnahme werden innerhalb 24 Stunden 70 % des Phenmetrazins ausgeschieden. Davon sind etwa 19 % unverstoffwechselt.[23] Während in Tierversuchen an Ratten nach subkutaner Injektion beide Stereoisomere gleich wirksam bei der Nahrungsaufnahme waren, wirkt die Levoform stärker nach oraler Gabe. Hinsichtlich der Stimulation des zentralen Nervensystems ist die Dextroform etwa viermal stärker bei beiden Applikationswegen.[24] Phenmetrazin ähnelt strukturell Ethcathinon, den aktiven Metaboliten des Apetitzüglers Amfepramon (Diethylpropion), der aber selektiv nur auf die Freisetzung von Norepinephrin wirkt.
Verwendung als Droge
Phenmetrazin wurde in vielen Ländern als Droge verwendet. Als der Konsum von Stimulanzien in Schweden in den 1950er Jahren erstmals gehäuft auftrat, wurde Phenmetrazin von den Konsumenten gegenüber Amphetamin und Methamphetamin bevorzugt.[25] In ihrem autobiographischen Roman Rush schreibt Kim Wozencraft über die von ihr als euphoriserend und aphrodisierend wahrgenommene Wirkung der Droge. Phenmetrazin wurde 1959 in Schweden als Betäubungsmittel eingestuft und 1965 vollständig vom Markt genommen. Die illegale Nachfrage wurde zunächst durch Schmuggel aus Deutschland, später auch aus Spanien und Italien befriedigt. Zuerst wurden Preludin-Tabletten geschmuggelt, doch schon bald begannen die Schmuggler, rohes Phenmetrazin-Pulver einzuführen. Schließlich wurde Amphetamin aufgrund seiner größeren Verfügbarkeit zum dominierenden Stimulans des Missbrauchs. Ein bekannter Anwender war Paul McCartney von den Beatles, die die Droge zu Beginn ihrer Karriere konsumierten.
Preludin wurde in den USA in den 1960er und frühen 1970er Jahren als Droge verwendet. Es konnte in Wasser zerkleinert, erhitzt und injiziert werden. Der Straßenname für die Droge in Washington, DC, lautete „Bam“.[26] Phenmetrazin wird weiterhin auf der ganzen Welt verwendet und missbraucht, unter anderem in Ländern wie Südkorea.[27]
Handelsnamen
Der Handelsname für Phenmetrazin-Hydrochlorid (Tabletten) in den USA, in Großbritannien und Deutschland war Preludin. Die Kombination von Phenmetrazinteoclat mit Fenbutrazat war in Deutschland als Cafilon (Dragees) im Markt.
Einzelnachweise
- RÖMPP Lexikon Chemie, 10. Auflage, 1996–1999: Band 4: M – Pk. S. 3248.
- Merck-Index 14
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- E. Mutschler: Arzneimittelwirkungen. 7. Auflage, 1996, WVG. S. 167 f.
- Externe Identifikatoren von bzw. Datenbank-Links zu Phenmetrazinhydrochlorid: CAS-Nummer: 1707-14-8, EG-Nummer: 216-950-6, ECHA-InfoCard: 100.015.409, PubChem: 92159, ChemSpider: 83204, Wikidata: Q27107702.
- Externe Identifikatoren von bzw. Datenbank-Links zu Phenmetrazinteoclat: CAS-Nummer: 13931-75-4, EG-Nummer: 237-701-8, ECHA-InfoCard: 100.034.260, PubChem: 84106, ChemSpider: 75877, Wikidata: Q27276355.
- R.B. Franklin: The fate of phenmetrazine in man and animals with observations on amphetamine and norephedrine metabolism in tamarin monkeys. Doctoral thesis, University of London, 1974.
- F.H. Clarke: cis- and trans-3-Methyl-2-phenylmorpholine. Journal of Organic Chemistry, Band 27 (1962), 3251–3253 (PDF).
- Boehringer, Albert; Boehringer, Ernst. "Improvements in or relating to the preparation of substituted morpholines" (GB773780).
- Patent US2835669A: Process for the production of substituted morpholines. Angemeldet am 29. Juni 1953, veröffentlicht am 20. Mai 1958, Erfinder: Otto Thoma. Priorität (nationale Erstanmeldung): 1. Juli 1952 (DE).
- O Thomä, H Wick: Über einige Tetrahydro-1,4-oxazine mit sympathicomimetischen Eigenschaften. In: Arch. Exp. Pathol. Pharmakol.. 222, 1954, S. 540.
- Antonio Martel: Preludin (Phenmetrazine) in the Treatment of Obesity. In: Can. Med. Assoc. J.. 76, Nr. 2, 1957, S. 117–20. PMID 13383418. PMC 1823494 (freier Volltext).
- Oriana Josseau Kalant: The Amphetamines: Toxicity and Addiction 1966, ISBN 0-398-02511-8.
- Spiegel Wie Champagner, Spiegel, 2. März 1960.
- Bomben auf St. Pauli, Spiegel, 14. Februar 1966.
- Abnehmen: Mehr Schaden als Nutzen? Zur Gewichtsreduktion bei gesunden Übergewichtigen, Arznei-Telegramm Nr. 12, 1999.
- Harry Auterhoff: Lehrbuch der pharmazeutischen Chemie. WVG, 1978, S. 413.
- Gavin McLaughlin, Michael H. Baumann, Pierce V. Kavanagh, Noreen Morris, John D. Power: Synthesis, analytical characterization, and monoamine transporter activity of the new psychoactive substance 4-methylphenmetrazine (4-MPM), with differentiation from its ortho - and meta - positional isomers. In: Drug Testing and Analysis. Band 10, Nr. 9, September 2018, S. 1404–1416, doi:10.1002/dta.2396, PMID 29673128, PMC 7316143 (freier Volltext) – (wiley.com [abgerufen am 24. August 2020]).
- Patent US20130203752: Phenylmorpholines and analogues thereof. Veröffentlicht am 20. Mai 2011, Erfinder: Bruce E. Blough, Richard Rothman, Antonio Landavazo, Kevin M. Page, Ann Marie Decker.
- PHENMETRAZINE hydrochloride. In: Journal of the American Medical Association. Band 163, Nummer 5, Februar 1957, S. 357, PMID 13385162.
- Hampson, J, J.A. Loraine, J.A. Strong: Phenmetrazine and Dexamphetamine in the Management of Obesity. In: The Lancet. 275, Nr. 7137, 1960, S. 1265–7. doi:10.1016/S0140-6736(60)92250-9. PMID 14399386.
- Rothman RB, Baumann MH: Therapeutic potential of monoamine transporter substrates. In: Current Topics in Medicinal Chemistry. 6, Nr. 17, 2006, S. 1845–59. doi:10.2174/156802606778249766. PMID 17017961.
- Anthony C Moffat, M David Osselton and Brian Widdop: Clarke's Analysis of Drugs and Poisons, ISBN 0-85369-473-7.
- Engelhardt, A: Studies of the Mechanism of the Anti-Appetite Action of Phenmetrazine. In: Biochem. Pharmacol.. 8, Nr. 1, 1961, S. 100. doi:10.1016/0006-2952(61)90520-2.
- Brecher, Edward M: The Swedish Experience. Abgerufen am 31. Oktober 2009.
- Leon Dash: Rosa Lee. HarperCollins, 1996, S. 109.
- Choi H, Baeck S, Jang M, Lee S, Choi H, Chung H: Simultaneous analysis of psychotropic phenylalkylamines in oral fluid by GC-MS with automated SPE and its application to legal cases. In: Forensic Science International. 215, Nr. 1–3, 10. Februar 2012, S. 81–87. doi:10.1016/j.forsciint.2011.02.011. PMID 21377815.