Nitroaromaten
Die Bezeichnung Nitroaromaten (auch Nitroarene genannt) umfasst alle organisch-chemischen Verbindungen, die mindestens eine Nitrogruppe unmittelbar an einem aromatischen Molekülgerüst tragen. Die Zugehörigkeit einer Verbindung zur Gruppe der Nitroaromaten ist unabhängig vom Vorhandensein weiterer funktioneller Gruppen und Substituenten, sie würde in solchen Fällen mehreren Substanzklassen angehören.[1]
Diese Substanzklasse lässt sich grob unterteilen in einkernige Nitroaromaten, deren Grundgerüst nur einen aromatisches Ring besitzt, und mehrkernige Nitroaromaten, deren aromatisches System aus mindestens zwei Ringen besteht. Eine weitere Unterteilungsmöglichkeit ist die Gruppierung in Mononitroaromaten, Dinitroaromaten, Trinitroaromaten etc., je nach Anzahl der im Molekül vorhandenen Nitrogruppen. Letztere Einteilung steht in engem Bezug zur Reaktivität und Stabilität der Verbindungen.
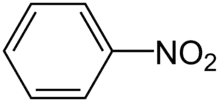
Der einfachste und bekannteste Vertreter ist das Nitrobenzol, ein einkerniges Mononitroaren.
Synthese
Die gängigste Methode der Herstellung von Nitroaromaten ist die direkte Nitrierung von Aromaten mit Hilfe von Nitriersäure.[2] Der mechanistische Typ dieser Reaktion ist die elektrophile aromatische Substitution, SE(Ar). Ein geeigneter aromatischer Ausgangsstoff wird meist unter Kühlung mit einer Mischung aus konzentrierter Salpetersäure und konzentrierter Schwefelsäure behandelt. Unter sorgfältig kontrollierten Reaktionsbedingungen wird dabei meist nur eine Nitrogruppe in das Molekül eingeführt.
Problematisch ist die Kontrolle der Reaktion bei Verwendung aktivierter Aromaten, z. B. Phenolen oder Phenolethern. Bei ungenügender Kühlung kann es hierbei zur mehrfachen Nitrierung kommen. Meist reicht zur Nitrierung aktivierter Aromaten bereits Salpetersäure allein aus.
Deaktivierte Aromaten (z. B. aromatische Carbonsäuren) dagegen müssen meist mit Nitriersäure oder rauchender Salpetersäure erhitzt werden, um eine Nitrierung zu erreichen.
Eigenschaften
Die Eigenschaften der Nitroaromaten hängen weitgehend von der Struktur des Gesamtmoleküls ab und lassen sich bei der großen Vielfalt der Derivate nicht einheitlich beschreiben. Die Nitrogruppe verleiht dem Molekül aufgrund ihrer Ladungen und der daraus folgenden Polarität ein zusätzliches Dipolmoment.[2] Dennoch sind auch mehrfach nitrierte Aromaten meist nur schlecht wasserlöslich, wenn sie nicht noch weitere polare Gruppen, z. B. Hydroxygruppen, tragen.
Auswirkungen auf das aromatische System
Nitrogruppen sind funktionelle Gruppen mit einem ausgeprägt elektronenziehenden Charakter und üben neben einem induktiven Effekt (−I-Effekt) auch einen recht starken mesomeren Effekt (−M-Effekt) auf das aromatische Grundgerüst aus.[2] Daraus resultieren
- eine Absenkung der Ladungsdichte im aromatischen System,
- eine geringere Reaktivität des Nitroarens gegenüber elektrophilen Reagenzien (verglichen mit der Reaktivität des entsprechenden Aromaten ohne Nitrogruppe),
- eine Regioselektivität zugunsten der meta-Position(en), relativ zur Nitrogruppe, bei weiterer elektrophiler Substitution am Nitroaren.
Explosivität
Eine hervorstechende Eigenschaft der mehrfach nitrierten Aromaten ist ihre Explosivität, die mit der Anzahl der Nitrogruppen je Molekül steigt. Während Nitrobenzol und die Dinitrobenzole vergleichsweise harmlose Verbindungen sind, können Trinitrobenzol, Tetranitrobenzol und besonders das Hexanitrobenzol bei Schlag oder Erwärmen sehr heftig explodieren. Diese Eigenschaft rührt daher, dass Nitrogruppen eine Art „internes Oxidationsmittel“ darstellen. Dadurch reagiert eine Verbindung mit genügend Nitrogruppen relativ zu ihrem Kohlenwasserstoffanteil (=verbrennbarer Anteil der Verbindung) ähnlich einer Mischung aus brennbarer Substanz und brandfördender Substanz, also einer „klassischen“ Explosivmischung (z. B. Schwarzpulver), jedoch in der Wirkung meist heftiger, da Brennstoff und Sauerstoffträger auf molekularer Ebene „vermischt“ sind.
Verwendung
Sprengstoffe
Die bereits erwähnte Explosivität mehrfach nitrierter Aromaten macht sie als Sprengstoffe interessant.[3] Zu nennen wären hier als Beispiele das 1,3,5-Trinitrobenzol (TNB), das wohl am meisten bekannte 2,4,6-Trinitrotoluol (TNT), die Pikrinsäure (2,4,6-Trinitrophenol), das N-Methyl-N,2,4,6-tetranitroanilin (Tetryl) und das 2,2',4,4',6,6'-Hexanitrostilben (HNS). Pikrinsäure ist besonders in Form ihrer Schwermetallsalze, z. B. Bleipikrat, sehr schlagempfindlich und wird als Initialsprengstoff eingesetzt. Das HNS ist ein temperaturbeständiger Sprengstoff, der durch Initialzündung zur Explosion gebracht wird.
Duftstoffe
Einige künstliche Moschusduftstoffe gehören ebenfalls zu den Nitroaromaten:[4]
- Moschus-Xylol (systematisch: 1-tert-Butyl-3,5-dimethyl-2,4,6-trinitro-benzol)
- Moschus-Keton (systematisch:1-(4-tert-Butyl-2,6-dimethyl-3,5-dinitro-phenyl)-ethanon)
Diese Substanzen sind sehr gut fettlöslich. Rückstände dieser Verbindungen wurden in Fischen und in der Muttermilch festgestellt. In einigen Ländern ist die Verwendung dieser Verbindungen stark eingeschränkt.[5][6]
Synthesezwischenprodukte
Nitroaromaten lassen sich durch eine Vielfalt von Reduktionsmitteln mit hohen Ausbeuten in aromatische Amine umwandeln. Aromatische Amine sind Basischemikalien zur Herstellung einer Fülle von synthetischen Farbstoffen,[3] und wurden von der in der zweiten Hälfte des 19. Jahrhunderts aufkeimenden chemischen Farbenindustrie meist auf diese Weise aus Nitroaromaten gewonnen. Durch die Reduktion von Nitrobenzol mit in situ aus Eisen, Zink oder Zinn und Salzsäure gebildetem Wasserstoff, erhielt man Anilin, welches u. a. den Weg zum industriell produzierten künstlichen Indigo ebnete.
Besonders in der Laborsynthese und der Forschung stellen Nitroaromaten auch heute noch wichtige Synthesezwischenprodukte zur Herstellung aromatischer Amine dar. Durch Anwendung milderer Reduktionsmethoden können auch aromatische Nitrosoverbindungen und N-Hydroxylamine aus Nitroaromaten erhalten werden. Da Nitrogruppen an Aromaten gegenüber einer Vielzahl von chemischen Umwandlungen und Reaktionsbedingungen (mit Ausnahme von Reduktionen) stabil sind, werden sie in mehrstufigen Synthesen gerne anstelle der reaktionsfreudigeren Aminogruppen eingesetzt und erst an passender Stelle der Synthesesequenz in Aminogruppen umgewandelt.
Toxizität
Die Giftwirkung von Nitroaromaten beruht in erster Linie auf der endogenen Umwandlung in Amine oder deren primäre Metabolite und gleicht der der aromatischen Amine, d. h. sie resultiert aus der Reduktion der Nitrogruppe zur Amino- oder N-Hydroxylaminogruppe.[1]
Nitroaromaten werden über den GIT. die Atemwege und die Haut sehr gut resorbiert und können z. T. im Fettgewebe gespeichert werden. Monozyklische Nitroaromaten werden hauptsächlich renal eliminiert. Sie können bei Hautkontakt zu Dermatitis und am Auge zu Konjunktivitis und zu Hornhautläsionen sowie nach oraler Aufnahme zu schmerzhaften Magenkoliken und Durchfällen führen. Die chronische Toxizität beim Menschen ist vorwiegend gekennzeichnet durch das Auftreten von Leberschäden und führt zu einer Gelbfärbung der Haut und der Nägel sowie eine braunrote Verfärbung der Haare. Fast alle Nitroaromaten sind mutagen.[3] Die Cancerogenität ist bisher nur im Tierversuch eindeutig nachgewiesen.[1]
Einzelnachweise
- Lexikon der Ernährung: Nitroaromaten - Lexikon der Ernährung, abgerufen am 17. August 2018
- Stefanie Federle, Stefanie Hergesell, Sebastian Schubert: Die Stoffklassen der organischen Chemie Praktisch und kompakt von Studenten erklärt. Springer-Verlag, 2017, ISBN 978-3-662-54968-1, S. 172 (eingeschränkte Vorschau in der Google-Buchsuche).
- Franz-Xaver Reichl: Taschenatlas der Toxikologie Substanzen, Wirkungen, Umwelt. Georg Thieme Verlag, 2002, ISBN 978-3-13-108972-4, S. 126 (eingeschränkte Vorschau in der Google-Buchsuche).
- Toxikologie der Stoffe: Toxikologie Band 2 - Toxikologie der Stoffe. John Wiley & Sons, 2012, ISBN 3-527-63555-6, S. 139 (eingeschränkte Vorschau in der Google-Buchsuche).
- Moschus Ambrette, Moschus Mosken, und Moschus Tibeten dürfen gemäß Verordnung (EG) Nr. 1223/2009 nicht mehr in kosmetischen Mitteln eingesetzt werden.
- M. Uhl, H. P. Hutter, G. Lorbeer: Polymoschus-Verbindungen in Humanblut II: Humanbiomonitoring von Moschusduftstoffen. Hrsg.: Bundesministerium für Gesundheit und Frauen. Wien 2005, ISBN 978-3-900019-71-6 (PDF – freier Volltext).