Eduard Zintl
Eduard Zintl (* 21. Januar 1898 in Weiden in der Oberpfalz; † 17. Januar 1941 in Darmstadt) war ein deutscher Chemiker, nach dem die chemischen Stoffklassen der Zintl-Phasen und Zintl-Ionen benannt sind sowie die Zintl-Grenze zwischen 3. und 4. Hauptgruppe im Periodensystem der Elemente.

Leben
Schulausbildung und Studium
Seine Schulzeit verbrachte Eduard Zintl in Weiden und Bayreuth. Nachdem er mit seiner Familie nach München umgezogen war, bestand er mit 18 Jahren die Abiturprüfung. Da zu dieser Zeit gerade der Erste Weltkrieg in Europa tobte, wurde Zintl zum Militärdienst eingezogen. Sein Chemiestudium an der Bayerischen Akademie der Wissenschaften konnte er somit erst mit 21 Jahren aufnehmen. Das hinderte ihn aber nicht an einer beispiellosen akademischen Karriere. Schon in den ersten Semestern fiel er durch überdurchschnittliche Studienleistungen auf – auch Otto Hönigschmid, Leiter des Deutschen Atomgewichtslaboratoriums, wurde auf ihn aufmerksam: Er machte ihn zum Famulus (Hilfsassistenten) und stellte ihm sein Privatlabor zur Verfügung, wo Eduard Zintl sich an Bestimmungen wichtiger Atomgewichte (Brom, Antimon, Silber, Gold, …) beteiligte. Er erhielt eine Sondergenehmigung, um mit seiner Dissertation zu beginnen, noch bevor er sein 2. Verbandsexamen abgelegt hatte.
Promotion und Habilitation
Zintl wurde 1923 mit der Arbeit „Revision des Atomgewichts des Broms durch vollständige Synthese des Bromsilbers“ promoviert. Als Privatassistent im Atomlabor betreute er anschließend Doktoranden von Otto Hönigschmid (u. a. Günther Rienäcker und Josef Goubeau) und widmete sich der bis dahin wenig beachteten potentiometrischen Titration, einer quantitativen Analysemethode. Auf diesem Gebiet wurde er bald schon zur Koryphäe.
Nebenbei verfasste er ein Lehrbuch mit dem Titel „Einführung in das Studium der anorganischen Chemie“. Angeregt von neueren Untersuchungen durch Charles August Kraus, fanden die tiefblauen Lösungen von Metallen in flüssigem Ammoniak sein immer größer werdendes Interesse. Bereits in München begann er mit deren genauerer Erforschung. Zwei Jahre nach seiner Promotion habilitierte sich Zintl 1925 im Fach Chemie.
1928 bis 1933: Professor an der Universität Freiburg
Zintl verblieb an der Münchner Akademie als Kurator, bis er 1928 einem Ruf als außerordentlicher Professor an die Albert-Ludwigs-Universität Freiburg folgte. Hier wurde er Leiter der anorganischen Abteilung des Chemischen Laboratoriums. Wenig von Ereignissen außerhalb der Forschungsarbeit abgelenkt, erarbeitete sich Eduard Zintl ein Thema, mit dem sein Name verbunden bleibt: das Gebiet der intermetallischen Phasen (Verbindungen zweier oder mehrerer Metalle) – genauer: der später nach ihm benannten Zintl-Ionen und Zintl-Phasen. Seine erste, recht kurze Veröffentlichung zu diesem Thema erschien 1929: „Salzartige Verbindungen des Natriums und ihr Übergang zu intermetallischen Phasen“. 1931 folgten ausführlichere Berichte über Arbeiten mit Blei, Zinn und vielen anderen Elementen in flüssigem Ammoniak. Für die Untersuchungen über intermetallische Phasen verlieh ihm 1938 der Verein Deutscher Chemiker die Liebig-Denkmünze.
Zintl entwickelte mit seinen Mitarbeitern Methoden, um luftempfindliche Substanzen mithilfe der Röntgendiffraktometrie zu untersuchen. Damit ließen sich luftinstabile Verbindungen wie die Alkalimetallhydride genauer untersuchen und beschreiben.
In seinen Vorlesungen an der Universität Freiburg vermittelte Zintl weniger die Besonderheiten der einzelnen chemischen Stoffe, sondern gab vorrangig einen Überblick über die Grundlagen, die nötig waren, um den Inhalt der Lehrbücher besser verstehen zu können. Denn „er wollte nicht vorlesen, was nachzulesen war“ (Zitat aus einem Nachruf auf Eduard Zintl).
Professor an der TH Darmstadt ab 1933
Ein Ruf als ordentlicher Professor an die Technische Hochschule Darmstadt erreichte den Chemiker 1933. Am 1. Oktober dieses Jahres trat er dort als Nachfolger von Lothar Wöhler die Position als Vorstand des Instituts für Anorganische Chemie an. Bereits im Jahre 1923 hatte er in seinem Lehrbuch geäußert, moderne Anorganische Chemie sei angewandte Physikalische Chemie; diese Auffassung konnte er nun für alle verdeutlichen: Zintl richtete an der TH Darmstadt eine physikalisch-chemische Abteilung ein und gab dem vereinigten Institut den Namen „Institut für Anorganische und Physikalische Chemie“.
Doch allmählich wurde klar, dass in diesem Institut zu wenig Platz vorhanden war, da in der Zwischenzeit neue chemische Apparaturen entwickelt worden waren, die für die Laborarbeit unverzichtbar wurden, aber einiges an Raum einnahmen. Zintl organisierte einen weiträumigen, modern ausgestatteten Neubau in unmittelbarer Nähe zum alten Bauwerk. Der Grundstein wurde am 1. Oktober 1937 gelegt. Zintl modernisierte auch den Unterrichtsplan für Studierende der Chemie in Darmstadt. Er richtete einen neuen Studiengang ein, bei dem auf eine Grundausbildung eine Ausbildung für Fortgeschrittene folgte. Dieses Konzept übernahm das Reichserziehungsministerium später in einer durchgreifenden Reform des Studiengangs Chemie an allen Universitäten und Fachhochschulen.
Im Gegensatz zu vielen Universitätsprofessoren, die sich nur der Forschung an ihren Instituten widmeten, kooperierte Zintl auch mit der chemischen Industrie und wurde Mitarbeiter der I.G. Farbenindustrie AG. Aus dieser Zusammenarbeit gingen u. a. neue Forschungsergebnisse über Oxo-Verbindungen und Oxide hervor. Doch trotz dieses Einflusses vonseiten der Industrie bekamen seine Arbeiten in Forschung und Lehre nicht den Charakter einer Zweckforschung: Zintl blieb der Grundlagenforschung treu. Auf der Reichsarbeitstagung der Deutschen Chemiker 1938 in Bayreuth fasste er seine Ansichten von Forschung zusammen:
„Wir treiben aber […] in der Wissenschaft eine Politik auf weite Sicht, und wir erstreben durch Grundlagenforschung eine umfassende Theorie, weil sie uns dem höchsten Ziel aller Wissenschaften näher bringt. Es besteht darin, Neues vorauszusagen. […] Damit wird aber alle Grundlagenforschung letzten Endes zur Zweckforschung auf weite Sicht.“
Nebenbei leitete er die Redaktion der Zeitschrift für anorganische und allgemeine Chemie.
Zintl verstarb am 17. Januar 1941 an einer schweren Erkrankung und erlebte den Einzug in das von ihm mit geplante Institut nicht mehr. Auf seiner Gedächtnisfeier am 21. Januar 1942 erhielt das neue Gebäude Zintl zu Ehren den Namen „Eduard-Zintl-Institut für anorganische und physikalische Chemie“.
Polyanionen und die Zintl-Grenze

Berichten von A. Joannis in den 1890er-Jahren zufolge bildeten sich bei der Reaktion von Blei mit Natrium in flüssigem Ammoniak intensiv grün gefärbte Lösungen.[1] Eduard Zintl interessierte sich für die Chemie, die hinter dieser Reaktion steckte. Er nutzte die Methoden der potentiometrischen Titration und der elektrolytischen Überführung, bei denen er Fachmann war, um dieses Phänomen zu untersuchen. Damit wies er erstmals nach, dass die gefärbten Lösungen polaren Charakter besaßen und also geladene Teilchen enthielten.
Eduard Zintl kam zu dem Schluss, dass es sich bei dieser Art von Teilchen um Polyanionen handelte, also um mehrere Atome desselben Elements, die sich zusammengelagert hatten und als Verband negative Ladung besaßen. Als Gegenion diente das von Lösemittelmolekülen umhüllte Alkalimetallkation. Bei der beschriebenen Reaktion von Blei mit Natrium in flüssigem Ammoniak bildete sich demnach ein polyanionisches Salz der Zusammensetzung [Na(NH3)x]+4[Pb9]4−. Die Polyanionen zerfielen jedoch, sobald er das Lösemittel vollständig entfernte.
Dass Halogene (Fluor, Chlor, Brom, Iod) und Chalkogene (Sauerstoff, Schwefel, Selen und Tellur) Anionen bilden konnten, war seit längerem bekannt. Aber Eduard Zintl hatte nun nachgewiesen, dass auch Elemente weiter links im Periodensystem (wie z. B. Blei) dazu befähigt waren. Er wies in folgenden Untersuchungen auch Polyanionen anderer Elemente nach – und zwar des Zinns, Antimons und Bismuts.
Es gab jedoch Elemente, bei deren Reaktion mit Natrium in flüssigem Ammoniak niemals Polyanionen entstanden – und das waren Elemente, die im Periodensystem mehr als vier Hauptgruppen vor den Edelgasen stehen (z. B. Indium, Thallium, Quecksilber). Hier bildeten sich immer nur unlösliche Verbindungen, die typische Legierungsstrukturen formten. Es waren dies die gleichen Produkte, die man auch durch das Zusammenschmelzen der reinen Metalle erhielt.
Zintl unterschied somit zwischen Anionenbildnern und Nicht-Anionenbildnern, also Elementen, die ein bis vier Hauptgruppen vor den Edelgasen stehen und zur Bildung von Anionen bzw. Polyanionen befähigt sind, und Elementen weiter links im Periodensystem, die diese Eigenschaft nicht besitzen. Diese Grenze zwischen dritter und vierter Hauptgruppe wurde in einem Nachruf an Eduard Zintl von Fritz Laves als Zintl-Grenze bzw. Zintl-Linie bezeichnet. Sie ist noch heute unter diesen Namen bekannt, auch wenn sie inzwischen als weniger allgemeingültig und sinnvoll angesehen wird als früher angenommen. (Denn inzwischen konnten auch Polyanionen des Indiums hergestellt werden – allerdings nicht in flüssigem Ammoniak, sondern in Reaktionen ohne Lösemittel bei viel höheren Temperaturen.)
Solche Polyanionen der schwereren Metalle, die früher nur in flüssigem Ammoniak bekannt waren, wurden später zu Ehren ihres Entdeckers als Zintl-Ionen bezeichnet.
Intermetallische Phasen
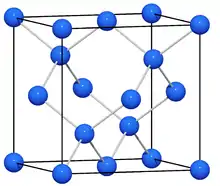
Bei der Reaktion von Elementen der 3. Hauptgruppe (z. B. Thallium) mit Natrium in flüssigem Ammoniak fand Eduard Zintl keine Polyanionen. Stattdessen erhielt er ein legierungsähnliches System. Bei dieser intermetallischen Verbindung (also der Verbindung zwischen den zwei Metallen Natrium und Thallium) wies er einen neuen, noch unbekannten Aufbau nach: die NaTl-Struktur. Das Besondere ist, dass die Atome der beiden Elemente (Thallium und Natrium) unabhängig voneinander jeweils so angeordnet sind wie die Kohlenstoffatome im Diamant.
Er erkannte erstmals das Prinzip, das hinter dem Aufbau vieler intermetallischer Phasen steckt: die Anionen bilden eine Struktur, die derjenigen entspricht, die ein Element mit der gleichen Anzahl Valenzelektronen auch einnimmt. In diesem Fall bildet das formal einfach negativ geladene Thalliumion (mit vier Valenzelektronen) eine Struktur, die der Kohlenstoff (in der vierten Hauptgruppe, also mit ebenfalls vier Valenzelektronen!) aufgrund derselben Bindigkeit genauso ausbildet. Diese Gesetzmäßigkeit bezeichnet man heute als klassisches Zintl-Konzept, es wurde später von Wilhelm Klemm und E. Busmann noch erweitert.
Von diesen neuen Ergebnissen beflügelt, untersuchte Eduard Zintl systematisch noch viele weitere Verbindungen von Metallen untereinander. Fritz Laves führte daraufhin in dem bereits erwähnten Nachruf an Eduard Zintl den Begriff Zintl-Phasen ein. Er hatte so erfolgreich einen Überbegriff für die vielen intermetallischen Verbindungen, die Zintl beschrieben hatte, gefunden.
Heutzutage meint der Begriff Zintl-Phase intermetallische Phasen mit stark ionischen Bindungsanteilen, also Stoffe, in denen die Art der Bindung eine Übergangsform zwischen Metall- und ionischer Bindung darstellt. Es sind dies die Alkali- und Erdalkali-Verbindungen mit Metallen oder Halbmetallen der dritten bis fünften Hauptgruppe, also von Komponenten mit relativ hohem Elektronegativitätsunterschied. Der Prototyp der Zintl-Phasen ist nach wie vor NaTl. Da Zintl-Phasen ionisch aufgebaut sind, sind aufgrund der zusätzlichen Gitterenergien ihre Bildungsenthalpien vergleichbar mit denen typischer Salze. Sie besitzen salzähnliche Sprödigkeit und Schmelzpunkte, die über denen der Metallkomponenten liegen. Zudem lösen sie sich im Unterschied zu Legierungen gut in koordinierenden Lösemitteln wie flüssigem Ammoniak.
Literatur
- H. W. Kohlschütter: Naturwissenschaften. 17, 1941, S. 240–244. doi:10.1007/BF01479156
- F. Laves: Naturwissenschaften. 17, 1941, S. 244–255. doi:10.1007/BF01479157
- Uta Deichmann: Flüchten, Mitmachen, Vergessen. Chemiker und Biochemiker in der NS-Zeit. Wiley-VCH, Weinheim 2001, ISBN 3-527-30264-6.
Weblinks
Einzelnachweise
- A. Joannis: Action of sodammonium and potassammonium on metals. In: C R Hebd Seances Acad Sci. 113, 1891, S. 795–798.