Monensin
Monensin ist eine antibiotisch wirksame Substanz aus der Gruppe der Polyether-Antibiotika und wurde aus dem Bakterium Streptomyces cinnamonensis isoliert.[6]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
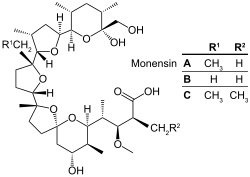 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Monensin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C36H62O11 | |||||||||||||||||||||
| Kurzbeschreibung | ||||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
Polyether-Antibiotika | |||||||||||||||||||||
| Wirkmechanismus |
Proteintransportinhibition | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 670,871 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten |
| |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Zusammensetzung
Das Stoffgemisch besteht größtenteils aus Monensin A, daneben kommen als Begleitsubstanzen Monensin B und C vor.[7]
Die Struktur von Monensin A wurde erstmals 1967 von Agtarap et al. beschrieben[8] und stellt die erste Strukturaufklärung eines Polyether-Antibiotikum dar. Die erste Totalsynthese gelang Kishi et al. 1979.[9] 1980 veröffentlichte W. Clark Still mit Kollegen eine weitere Totalsynthese.
| Komponente | Summenformel | Molare Masse |
|---|---|---|
| Monensin A | C36H62O11 | 670,87 g·mol−1 |
| Monensin B | C35H60O11 | 656,84 g·mol−1 |
| Monensin C | C37H64O11 | 684,90 g·mol−1 |
Wirkmechanismus
Monensin A ist ein mit den Kronenethern verwandtes Ionophor mit einer Neigung zur Komplexbildung mit einfach geladenen Kationen, wie Li+, Na+, K+, Rb+, Ag+ und Tl+.[10][11] Es verfügt über die Fähigkeit, diese Kationen elektroneutral durch die Lipidmembran der Zelle zu transportieren und fungiert als wichtiger Na+/H+-Antiporter. Neuen Forschungsergebnissen zufolge wäre es möglich, dass Monensin Natriumionen nicht nur elektroneutral, sondern auch elektrogen transportiert.[12] Dieser Ansatz würde nicht nur die ionophoren und damit einhergehenden antibakteriellen Eigenschaften der Grundsubstanz erklären, sondern auch die der Derivate, die keine Carboxygruppen besitzen.
Monensin A und seine Derivate blockieren den intra- und interzellulären Proteintransport und zeigen dadurch antibiotische, antimalarische und weitere biologische Aktivitäten.[13][14]
Verwendung
Monensin wird in der industriellen Tierproduktion von Geflügel als Futtermittelzusatzstoff zur Behandlung der Kokzidiose und Histomoniasis verwendet. Die Verwendung in der Rindermast[15] ist in der EU seit 2006 verboten.[16] Im Januar 2013 wurde Monensin unter dem Namen Kexxtone zur Vorbeugung gegen die Stoffwechselstörung Ketose bei Milchkühen in der peripartalen Phase zugelassen.[17]
Weiterhin wird Monensin, wie auch seine Derivate Monensinmethylester und besonders Monensindecylester, in der Elektrochemie als ionenselektive Elektrode verwendet.[18][19][20]
Toxikologie
Monensin zeigt ionophore Aktivität in Säugetierzellen und ist daher giftig. Dies ist besonders für Pferde gefährlich, bei denen die letale Dosis fünfundzwanzigfach niedriger liegt als bei Wiederkäuern. Vergiftungen von Pferden durch versehentlich Verfütterung von für Kühe vorgesehenem mit Monensin versetztem Kraftfutter haben in der Vergangenheit schon mehrfach zu Todesfällen geführt. Die Verunreinigung des Futters geschah in den meisten bekannten Fällen bei gleichzeitiger Zubereitung von Futterchargen für Rinder und Pferde im gleichen Futtermittelbetrieb. Diese ist daher nach Möglichkeit zu vermeiden. Der Tod wird durch eine Nekrose des Herzmuskels und einem daraus resultierenden Herzstillstand verursacht. Weitere Symptome umfassen Kreislaufsstörung mit auffälligem Puls, Tachykardie und Herzrhythmusstörungen. Pferde, die die Vergiftung überleben, zeigen nach zwei Monaten keine Auffälligkeiten mehr.[3]
Einzelnachweise
- G. W. A. Milne: Gardner's Commercially Important Chemicals: Synonyms, Trade Names, and Properties. 1. Auflage. John Wiley & Sons, Hoboken 2005, ISBN 0-471-73661-9, S. 422 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Monensin sodium salt – 90–95% (TLC) bei Sigma-Aldrich, abgerufen am 8. Mai 2016 (PDF).
- G. R. Doonan, C. M. Brown, T. P. Mullaney, D. B. Brooks, E. G. Ulmanis, and M. R. Slanker: Monensin poisoning in horses – an international incident. In: Canadian Veterinary Journal. 30, Nr. 2, Februar 1989, S. 165–169. PMID 17423238. PMC 1681029 (freier Volltext).
- Chemical Sampling Information - Monensin. USDL Occupational Safety and Health Administration, abgerufen am 9. Mai 2016 (englisch).
- M. Petrovic, S. Perez, D. Barcelo: Analysis, Removal, Effects and Risk of Pharmaceuticals in the Water Cycle: Occurrence and Transformation in the Environment. 2. Auflage. Elsevier, Amsterdam 2013, ISBN 0-444-62694-8, S. 458 (eingeschränkte Vorschau in der Google-Buchsuche).
- D. Łowicki, A. Huczyński: Structure and Antimicrobial Properties of Monensin A and Its Derivatives: Summary of the Achievements. In: BioMed Research International. 2013, 13. Februar 2013. doi:10.1155/2013/742149. PMC 3586448 (freier Volltext).
- United States Pharmacopoeia (USP) 32–National Formulary (NF) 27, S. 3001.
- A. Agtarap, J. W. Chamberlin, M. Pinkerton, L. K. Steinrauf: Structure of monensic acid, a new biologically active compound. In: Journal of the American Chemical Society. 89, Nr. 22, Oktober 1967, S. 5737–5739. doi:10.1021/ja00998a062.
- K. C. Nicolaou, E. J. Sorensen: Classics in Total Synthesis: Targets, Strategies, Methods. VCH, Weinheim, Germany 1996, ISBN 3-527-29284-5, S. 185–187.
- A. Huczyński, M. Ratajczak-Sitarz, A. Katrusiak, B. Brzezinski: Molecular structure of the 1:1 inclusion complex of Monensin A lithium salt with acetonitrile. In: Journal of Molecular Structure. 871, Nr. 1–3, März, S. 92–97. doi:10.1016/j.molstruc.2006.07.046.
- M. Pinkerton, L. K. Steinrauf: Molecular structure of monovalent metal cation complexes of monensin. In: Journal of Molecular Biology. 49, Nr. 3, 14. Mai 1970, S. 533–546. doi:10.1016/0022-2836(70)90279-2.
- A. Huczyński, J. Janczak, D. Łowicki, B. Brzezinski: Monensin A acid complexes as a model of electrogenic transport of sodium cation. In: Biochimica et Biophysica Acta – Biomembranes. 1818, September 2012, S. 2108–2119. doi:10.1016/j.bbamem.2012.04.017.
- H. H. Mollenhauer, D. J. Morre, L. D. Rowe: Alteration of intracellular traffic by monensin; mechanism, specificity and relationship to toxicity. In: Biochimica et Biophysica Acta – Biomembranes. 1031, Nr. 2, 7. Mai 1990, S. 225–246. doi:10.1016/0304-4157(90)90008-Z.
- A. Huczyński, J. Stefańska, P. Przybylski, B. Brzezinski, F. Bartl: Synthesis and antimicrobial properties of Monensin A esters. In: Bioorganic & Medicinal Chemistry Letters. 18, Nr. 8, 15. April 2008, S. 2585–2589. doi:10.1016/j.bmcl.2008.03.038.
- P. Butaye, L. A. Devriese, F. Haesebrouck: Antimicrobial Growth Promoters Used in Animal Feed: Effects of Less Well Known Antibiotics on Gram-Positive Bacteria. In: Clinical Microbiology Reviews. 16, Nr. 2, April 2003, S. 175–188. doi:10.1128/CMR.16.2.175-188.2003.
- J. I. R. Castanon: History of the Use of Antibiotic as Growth Promotersin European Poultry Feeds. In: Poultry Science. 86, Nr. 11, 30. Juli 2007, S. 2466–2471. doi:10.3382/ps.2007-00249.
- Committee for Medicinal Products for Veterinary Use: CVMP assessment report for Kexxtone (EMEA/V/C/002235). (PDF) European Medicines Agency, 8. September 2012, abgerufen am 10. Mai 2016 (englisch).
- K. Tohda, K. Suzuki, N. Kosuge, H. Nagashima, K. Watanabe, H. Inoue, T. Shirai: A Sodium Ion Selective Electrode Based on a Highly Lipophilic Monensin Derivative and Its Application to the Measurement of Sodium Ion Concentrations in Serum. In: Analytical Sciences. 6, Nr. 2, 16. Januar 1990, S. 227–232. doi:10.2116/analsci.6.227.
- N. Kim, K. Park, I. Park, Y. Cho, Y. Bae: Application of a taste evaluation system to the monitoring of Kimchi fermentation. In: Biosensors and Bioelectronics. 20, Nr. 11, 15. Mai 2005, S. 2283–2291. doi:10.1016/j.bios.2004.10.007.
- K. Toko: Taste Sensor. In: Sensors and Actuators B: Chemical. 64, Nr. 1–3, 10. Juni 2000, S. 205–215. doi:10.1016/S0925-4005(99)00508-0.