Metolachlor
Metolachlor ist ein Gemisch von vier isomeren chemischen Verbindungen aus der Gruppe der Carbonsäureamide und Chloracetanilide.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-N-(1-methoxypropan-2-yl)acetamide_200.svg.png.webp) | |||||||||||||||||||
| Gemisch von vier Stereoisomeren (Enantiomere und Atropisomere), siehe Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Metolachlor | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C15H22ClNO2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 283,80 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
1,12 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck |
<0,1 Pa (20 °C)[2] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Metolachlor wurde von Ciba-Geigy entwickelt. In den 1970er Jahren wurde die Wirkung von (rac)-Metolachlor beobachtet und ein Syntheseverfahren und ein Patent angemeldet. Ab 1978 wurde die Verbindung in großem Umfang (>10.000 t pro Jahr) produziert und ab 1982 die Stereoisomere in ihrer Wirkung einzeln untersucht, wobei sich die besondere Wirksamkeit von (S)-Metolachlor herausstellte. Nach einigen Versuchen mit Katalysatoren aus Rhodium- und Iridiumverbindungen wurde 1993 ein Prozess mit einem Iridium-Josiphos-Komplex (Iridiumferrocenyldiphosphin) für die großtechnische Produktion entwickelt. Im gleichen Jahr lief das Patent für (rac)-Metolachlor aus und 1996 startete die großtechnische Herstellung von (S)-Metolachlor.[4] Heute stellt dieses eines der am häufigsten eingesetzten Herbizide in den USA dar. In Deutschland, Österreich und der Schweiz ist (RS)-Metolachlor in keinem zugelassenen Pflanzenschutzmittel enthalten.[5] (S)-Metolachlor ist dagegen in vielen Staaten der EU und in der Schweiz in mehreren Pflanzenschutzmitteln enthalten.[6] Entsprechend ist das Grundwasser in der Schweiz mit Metolachlor und den verschiedenen Metaboliten von Metolachlor belastet.[7]
Gewinnung und Darstellung
Metolachlor wird heute durch stereoselektive Synthese gewonnen. Es kann durch Reaktion von 6-Ethyl-2-toluidin mit Methoxyaceton oder 2-Brommethoxypropan und anschließende Reaktion mit Chloressigsäurechlorid gewonnen werden.[8]
Stereochemie
Metolachlor kommt in zwei enantiomeren Formen vor (R)- bzw. (S)-Metolachlor, wobei die (S)-Form die wirksamere ist. Deshalb werden seit einiger Zeit Herstellungsverfahren bevorzugt, bei welcher vermehrt die (S)-Form erzeugt wird. Diese Form wird als (S)-Metolachlor mit mehr als 80 % Anteil der (S)-Form verkauft.
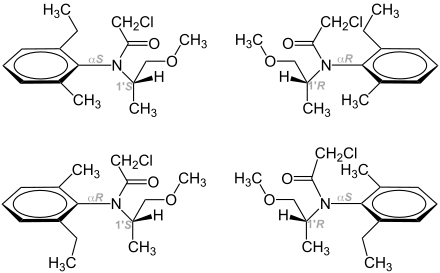
Eine Besonderheit besteht darin, dass die beiden Epimere zusätzlich als Atropisomere vorliegen, es gibt also vier Stereoisomere des Metolachlors. Beide Atropisomere von (S)-Metolachlor [(αR,1' S)- und das (αS,1' S)-Isomere] haben die gleiche biologische Wirkung.[9] Andererseits sind beide Atropisomere von (R)-Metolachlor [(αR,1' R)- und (αS,1' R)-Isomer] inaktiv.[10]
Eigenschaften
Der Flammpunkt von Metolachlor liegt bei 190 °C und die Zündtemperatur bei 435 °C.
Verwendung
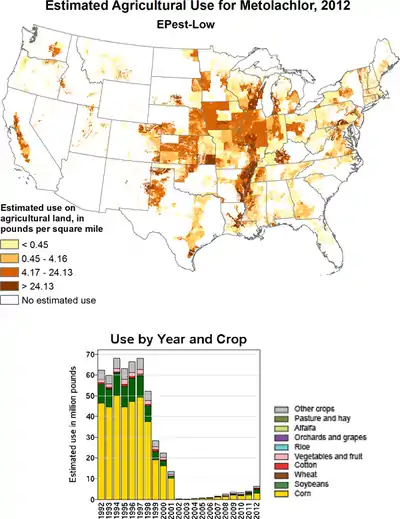
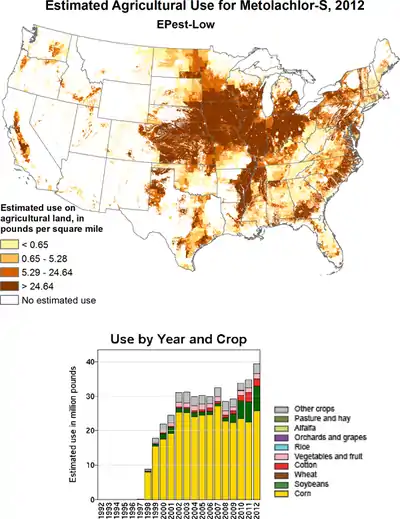
Metolachlor wird als Herbizid (häufig auch in Kombination mit anderen Herbiziden wie z. B. Terbuthylazin oder Atrazin) gegen Gräser und Hirseunkräuter bei Mais, Sojabohnen, Erdnüssen und Baumwolle eingesetzt. Sie wirkt durch Hemmung von Elongasen und der Geranylgeranyl-Pyrophosphat (GGPP) Zyklisierungsenzyme bei Gibberellinen.
In den USA wurde von 1998 bis 2002 (RS)-Metolachlor durch (S)-Metolachlor ersetzt, von dem 2012 mehr als 18.000 Tonnen eingesetzt wurden.
Sicherheitshinweise
Die Verwendung von Metolachlor in Dekorationsgegenständen und Spielen ist nicht zugelassen. Es wirkt auf Wasserorganismen sehr giftig.[2]
Siehe auch
Einzelnachweise
- Datenblatt Metolachlor bei Extoxnet, abgerufen am 12. Juni 2016.
- Eintrag zu Metolachlor in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu S-metolachlor (ISO); 2-chloro-N-(2-ethyl-6-methylphenyl)-N-[(2S)-1-methoxypropan-2-yl]acetamide; (RaSa)-2-chloro-N-(6-ethyl-o-tolyl)-N-[(1S)-2-methoxy-1-methylethyl]acetamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 30. Dezember 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Hans-Ulrich Blaser, Elke Schmidt: Asymmetric catalysis on industrial scale: challenges, approaches and solutions. Wiley-VCH, Weinheim 2004, ISBN 3-527-30631-5, S. 68.
- Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Metolachlor in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 11. März 2016.
- Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu S-Metolachlor in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 11. März 2016.
- Pflanzenschutzmittel im Grundwasser. In: bafu.admin.ch. Abgerufen am 4. November 2019.
- Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 0-8155-1853-6, S. 37 (eingeschränkte Vorschau in der Google-Buchsuche).
- H.-U. Blaser: The Chiral Switch of (S)-Metolachlor: A Personal Account of an Industrial Odyssey in Asymmetric Catalysis. In: Advanced Synthesis & Catalysis. Band 344, Nr. 1, 2002, S. 17–31, doi:10.1002/1615-4169(200201)344:1<17::AID-ADSC17>3.0.CO;2-8.
- H.-U. Blaser: Industrielle asymmetrische Hydrierung ”Made in Switzerland“. In: Nachrichten aus der Chemie. Band 58, Nr. 9, 2010, S. 864–867, doi:10.1002/nadc.201074031.

