Malonestersynthese
Die Malonestersynthese ist eine Reaktion in der organischen Chemie zur Herstellung von alkylierten Malonsäureestern. Sie dient dazu, nach Verseifung und anschließender Decarboxylierung, substituierte Essigsäuren zu erhalten. Man kann auch zweifach alkylieren und erhält bei doppelter Substitution mit dem gleichen Rest symmetrisch disubstituierte Essigsäuren, man kann aber auch in zwei Schritten unterschiedliche Substituenten einführen und erhält dann unsymmetrische Essigsäurederivate.
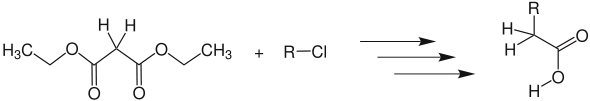
Alkylierte Malonester dienen auch als Synthesebausteine, z. B. zur Herstellung von Barbitursäurederivaten wie Veronal, die als Schmerz- und Schlafmittel Verwendung finden – heute aber mehrheitlich zur Euthanasierung von Tieren verwendet werden.
Mechanismus
Im ersten Schritt wird der Malonester durch eine starke Base wie z. B. einem Alkoholat in α-Position d. h. an der Methylengruppe deprotoniert. Anschließend wird ein Halogenalkan vom deprotonierten α-Kohlenstoff, nucleophil angegriffen. Man erhält einen α-alkylierten Malonester. Die Estergruppen werden basenkatalysiert hydrolysiert. Durch Hitzeeinwirkung decarboxyliert (CO2 wird abgespalten) die zuvor entstandene Dicarbonsäure.

- Synthese einer α-substituierten Essigsäure aus dem für gewöhnlich verwendeten Malonsäurediethylester. (X = Br, Cl oder I, R = Alkylrest)
Funktionsweise
Durch die Flankierung des α-Kohlenstoffs durch zwei Estergruppen sind die dort gebundenen Wasserstoffatome besonders acide (pKs = 13).[1] Folglich ist eine Deprotonierung an dieser Position begünstigt. Die Estergruppen lassen sich basenkatalysiert hydrolysieren (Esterhydrolyse). Aufgrund der resultierenden Carbonsäure in β-Position ist eine Decarboxylierung durch Erhitzen stark erleichtert und wird durch die sauren Reaktionsbedingungen noch weiter begünstigt. Die nucleophile Substitution des Halogenalkans folgt einem SN2-Mechanismus. Demnach sind verzweigte Alkylreste des Halogenalkans wegen der sterischen Hinderung für die Reaktion ungünstig. Hinsichtlich der nucleophilen Eigenschaften von Basen, sollte eine Base verwendet werden, die bei einer Substitution von einem der Carbonylkohlenstoffe zum gleichen Ester führt. Beispielsweise für Malonsäurediethylester, Ethanolat.
Einzelnachweise
- Paula, Yurkanis, Bruice: Organic Chemistry. 4. Auflage, Prentice-Hall, 2003, ISBN 0-131-41010-5, S. 821.
Literatur
- Paula, Yurkanis, Bruice: Organic Chemistry. 4. Auflage, Prentice-Hall, 2003, ISBN 0-131-41010-5, S. 821–822.
- K. P. C. Vollhardt, Neil E. Schore, Organische Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, 4. Auflage, H. Butenschön, ISBN 3-527-31380-X, S. 1228–1229.