Lanthanfluorid
Lanthanfluorid ist eine chemische Verbindung aus der Gruppe der Fluoride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ La3+ _ F− | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe |
P3c1 (Nr. 165) | |||||||||||||||
| Gitterparameter |
a = 719 pm | |||||||||||||||
| Koordinationszahlen |
La[9], F[3] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lanthanfluorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | LaF3 | |||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 195,90 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
5,9 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
2327 °C[2] | |||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, löslich in starken Mineralsäuren[2] | |||||||||||||||
| Brechungsindex |
1,59[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vorkommen
Lanthanfluorid kommt natürlich als Mineral Fluocerit-(La) vor, in dem neben Lanthan auch Cer enthalten ist. Nach dem amerikanischen Naturforscher S.T. Tyson wird das cerreiche Lanthanfluoridmineral auch Tysonit genannt.[5][6]
Gewinnung und Darstellung
Lanthanfluorid kann durch Reaktion von Fluorwasserstoff mit Lanthannitrat oder Lanthanchlorid gewonnen werden.
Auch die Reaktion von Lanthanoxid mit Ammoniumhydrogendifluorid ist möglich.
Eigenschaften
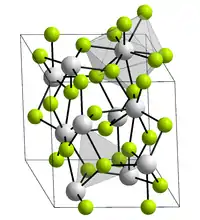
Lanthanfluorid kristallisiert trigonal in der Raumgruppe P3c1 (Raumgruppen-Nr. 165) mit den Gitterparametern a = 719 pm und c = 735 pm sowie sechs Formeleinheiten pro Elementarzelle.[7] Hierbei ist jedes Lanthanatom in der Kristallstruktur von neun Fluorid-Ionen in Form eines verzerrten, dreifach-überkappten trigonalen Prismas umgeben, während die Fluoratome jeweils trigonal-planar von drei Lanthanatomen koordiniert werden.[8]
Lanthanfluorid hat bei erhöhten Temperaturen eine Ionenleitfähigkeit, die auf der Beweglichkeit von Fluoridionen beruht, die sich in den Flouridleerstellen von Schottky-Defekten bewegen.[9] Dotiert man das Lanthanfluorid mit dem Fluorid eines zweiwertigen Metalls, z. B. Ca2+, Ba2+ oder Eu2+, so kann die Ionenleitfähigkeit schon bei Raumtemperatur beträchtliche Werte erreichen (siehe auch Verwendung).
Lanthanfluorid ist unlöslich in Wasser, Salzsäure und Salpetersäure; in konzentrierter Schwefelsäure löst es sich unter Bildung von Fluorwasserstoff HF.[6]
Verwendung
Lanthanfluorid wird zur Herstellung des reinen Metalls Lanthan verwendet. Hierfür wird das in Lanthanmineralien vorkommende Lanthanoxid mittels Fluorwasserstoff in Lanthanfluorid überführt, welches dann metallothermisch mittels Calcium oder Magnesium zum Metall reduziert wird. Lanthanfluorid wird auch als optisches Material, z. B. für Faseroptiken oder für Fluoreszenzlampen verwendet.[10] Dotiert mit Europium dient LaF3 als fluoriddurchlässige Membran (Festelektrolyt) in Fluoridelektroden zum Nachweis von Fluorid-Ionen.
Weblinks
- The Mobility of Ions in Lanthanum Fluoride Nanoclusters
- TRANSPARENT LANTHANUM FLUORIDE GLASS-CERAMICS (WIPO)
- W.W. Moses, S.E. Derenzo: The Scintillation Properties of Cerium-Doped Lanthanum Fluoride. In: Nuclear Instruments and Methods in Physics Research Section A: Accelerators. Spectrometers, Detectors and Associated Equipment, Vol. 299, Band 1–3, 20. Dezember 1990, S. 51–56 doi:10.1016/0168-9002(90)90746-S.
Einzelnachweise
- Datenblatt Lanthanfluorid bei AlfaAesar, abgerufen am 2. April 2010 (PDF) (JavaScript erforderlich).
- Lanthanum Fluoride bei American Elements
- Lanthanfluorid bei Nivotechnology
- Datenblatt Lanthanum(III) fluoride bei Sigma-Aldrich, abgerufen am 6. Mai 2017 (PDF).
- Oscar D. Allen, W. J. Comstock: Bastnaesite and tysonite from Colorado. In: American Journal of Science. Band 19, Nr. 113, Mai 1880, S. 390–393, doi:10.2475/ajs.s3-19.113.390.
- Streng: Neues Jahrbuch für Mineralogie, Geologie and Paläontologie. II. Band. Schweizerbart'sche Verlagshandlung (E. Koch), Stuttgart 1881, S. 174 (online auf den Seiten von The Internet Archive).
- A. Zalkin, D. H. Templeton: Refinement of the trigonal crystal structure of lanthanum trifluoride with neutron diffraction data. In: Acta Crystallographica. B 41, 1989, S. 91–93; doi:10.1107/S0108768185001689.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 87. Auflage. (Internet-Version: 2006–2007), CRC Press/Taylor and Francis, Boca Raton, FL, Fluid Properties, S. 6-113 (eingeschränkte Vorschau in der Google-Buchsuche).
- William L. Fielder: Ionic Conductivity of Lanthanum Fluoride. Hrsg.: National Aeronautics and Space Administration NASA. 1969 (nasa.gov [PDF]).
- azom.com: Lanthanum Fluoride