Lanthanchlorid
Lanthanchlorid ist eine chemische Verbindung aus der Gruppe der Chloride.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
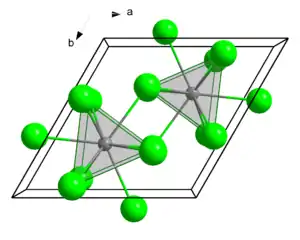 | ||||||||||
| _ La3+ _ Cl− | ||||||||||
| Kristallsystem | ||||||||||
| Raumgruppe |
P63/m (Nr. 176) | |||||||||
| Gitterparameter |
a = 748 pm | |||||||||
| Koordinationszahlen |
La[9], Cl[3] | |||||||||
| Allgemeines | ||||||||||
| Name | Lanthanchlorid | |||||||||
| Andere Namen | ||||||||||
| Verhältnisformel | LaCl3 | |||||||||
| Kurzbeschreibung |
weißes Pulver[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 245,26 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
1812 °C[4] | |||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Lanthanchlorid kann durch Reaktion von Lanthanoxid mit Chlorwasserstoff gewonnen werden.
Eigenschaften
Lanthanchlorid bildet weiße hexagonale Kristalle, die hygroskopisch sind. Es kristallisiert in der Raumgruppe P63/m (Raumgruppen-Nr. 176) mit den Gitterparametern a = 748 pm, c = 436 pm und zwei Formeleinheiten pro Elementarzelle. Das Heptahydrat kristallisiert monoklin mit den Gitterparametern a = 1237 pm, b = 1068 pm, c = 923 pm und einem Winkel von 114,3°.[3] Das Heptahydrat wandelt sich oberhalb von 90 °C in das Anhydrat um.[7]
Verwendung
Lanthanchlorid wird als milde Lewis-Säure für chemische Reaktionen verwendet, die normalerweise saure Bedingungen erfordern, wie zum Beispiel der Umbau von Aldehyden zu Acetalen unter nahezu neutralen Bedingungen. Es dient auch als Katalysator beim Fluid catalytic cracking.[8] Das Heptyhydrat wird in der Medizin als Kalziumkanalblocker eingesetzt[7] und dient weiterhin in der Wasserwirtschaft zur Eindämmung von Algenwachstum durch Bindung von Phosphaten.[9]
Literatur
- Xiao He, Zhiyong Zhang, Haifeng Zhang, Yuliang Zhao, Zhifang Chai: Neurotoxicological Evaluation of Long-Term Lanthanum Chloride Exposure in Rats. In: Toxicological Sciences, 2008, 103 (2), S. 354–361; doi:10.1093/toxsci/kfn046.
Weblinks
Einzelnachweise
- Eintrag zu LANTHANUM CHLORIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. September 2021.
- Datenblatt Lanthanum chloride bei Acros, abgerufen am 20. Juli 2010.
- Jean DAns, Ellen Lax: Taschenbuch für Chemiker und Physiker, Vols. 1–3: Elemente, anorganische Verbindungen und Materialien, Minerale, Vol. III, ISBN 978-3-540-60035-0, S. 1463 (eingeschränkte Vorschau in der Google-Buchsuche); abgerufen am 20. Juli 2010.
- Datenblatt Lanthanum(III) chloride anhydrous bei Sigma-Aldrich, abgerufen am 20. Juli 2010 (PDF).
- Eintrag zu Lanthan(III)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- American Elements: Lanthanum chloride, Anhydrous, abgerufen am 6. Juni 2018.
- Datenblatt Lanthanum(III) chloride heptahydrat bei Sigma-Aldrich, abgerufen am 20. Juli 2010 (PDF).
- Metall Rare Earth Limited: Lanthanchlorid, abgerufen am 30. Januar 2017.
- Blue Line: Lanthanum chloride solution (Memento vom 14. August 2010 im Internet Archive).


