Lactaldehyd
Lactaldehyd (oder 2-Hydroxypropanal) ist eine chemische Verbindung aus der Reihe der Hydroxyaldehyde. Die Synthese und Eigenschaften der Verbindung wurden erstmals 1908 von Alfred Wohl beschrieben.[1]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
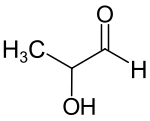 | ||||||||||||||||||||||
| Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Lactaldehyd | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C3H6O2 | |||||||||||||||||||||
| Kurzbeschreibung |
geruchloser Feststoff mit schwach bitterem Geschmack[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 74,08 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Schmelzpunkt |
105 °C[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Isomere
Lactaldehyd ist chiral, es bildet aufgrund des Stereozentrums am α-C-Atom zwei Enantiomere aus, die als (R)- und (S)-Lactaldehyd [Synonyme: D-(−)- und L-(+)-Lactaldehyd] bezeichnet werden.
| Isomere von Lactaldehyd | ||
| Name | (S)-Lactaldehyd | (R)-Lactaldehyd |
| Andere Namen | L-Lactaldehyd (+)-Lactaldehyd | D-Lactaldehyd (−)-Lactaldehyd |
| Strukturformel | 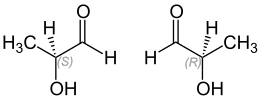 | |
| CAS-Nummer | 3913-64-2 | 3946-09-6 |
| 598-35-6 (Racemat) | ||
| EG-Nummer | – | – |
| 809-415-9 (Racemat) | ||
| ECHA-Infocard | – | – |
| 100.237.284 (Racemat) | ||
| PubChem | 439231 | 439350 |
| 855 (Racemat) | ||
| DrugBank | DB03776 | – |
| – (Racemat) | ||
| Wikidata | Q28529704 | Q27102246 |
| Q4381828 (Racemat) | ||
Synthese
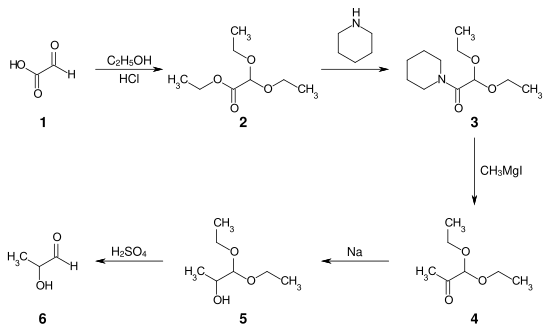
Bei der Erstsynthese wird das Calciumsalz der Glyoxylsäure 1 mit Ethanol und Salzsäure zum Diethoxyessigsäureethylester 2 verestert und acetalisiert. Diese Zwischenstufe wird anschließend mit Piperidin zum Carbonsäureamid 3 umgesetzt. Die Grignard-Reaktion des Piperidids mit Methylmagnesiumiodid ergibt das Keton 4 – das Aldehydacetal des Methylglyoxals. Dieses Keton lässt sich mit Natrium in Ethanol zu dem Acetal des Lactaldehyds 5 reduzieren. Das Acetal wird abschließend mit verdünnter Schwefelsäure zum Lactaldehyd 6 verseift.[3]
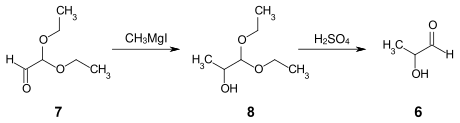
In einer alternativen Synthese, 1935 von Hermann Otto Laurenz Fischer und Erich Baer beschrieben, wird Diethoxyacetaldehyd[4] 7 in einer Grignard-Reaktion mit Methylmagnesiumiodid zum Lactaldehyddiethylacetal 8 umgesetzt und anschließend zum Lactaldehyd 6 verseift.[5]
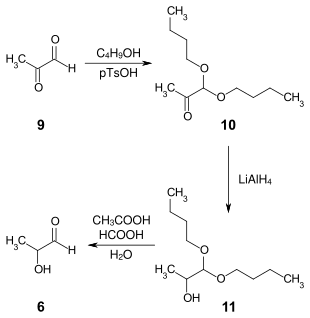
1952 wurde von John Kenyon Netherton Jones ein weiterer synthetischer Zugang zu Lactaldehyd veröffentlicht. Dabei wird die Aldehydgruppe von Methylglyoxal 9 mit Butanol und p-Toluolsulfonsäure (pTsOH) als Katalysator selektiv in das Dibutylacetal 10 überführt. Die Reduktion mit Lithiumaluminiumhydrid in Ether führt zum Lactalaldehyddibutylacetal 11, das im abschließenden Schritt in einem Gemisch von Eisessig, Wasser und Ameisensäure zum Lactaldehyd 6 hydrolysiert wird.[6]
Eigenschaften
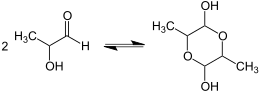
Bereits Wohl konnte zeigen, dass Lactaldehyd in einer frisch bereiteten wässrigen Lösung als Dimer vorliegt und langsam in die monomolekulare Form übergeht.[1] Dieses Verhalten wurde 1982 durch NMR-, Raman- und Infrarotspektroskopie bestätigt und im Detail untersucht.[7] Durch Umkristallisation aus verschiedenen Lösungsmitteln kann man drei Kristallformen isolieren, bei denen es sich um Konfigurationsisomere von 3,6-Dimethyl-1,4-dioxan-2,5-diol – ein cyclisches Halbacetal mit einer 1,4-Dioxan-Grundstruktur – handelt. Diese entstehen durch die Dimerisierung des offenkettigen DL-Lactaldehyd:
In einer DMSO-d6-Lösung erhält man aus den drei verschiedenen Kristallformen nach einiger Zeit ein identisches 1H-NMR-Spektrum, das sich aus der Überlagerung der Spektren der Konfigurationsisomeren 2, 3 und 4 ergibt:
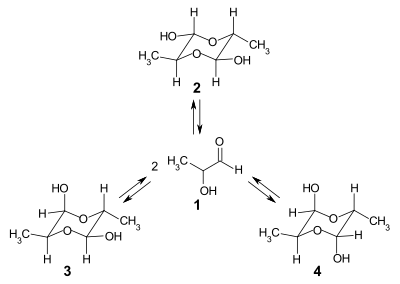
Somit stehen diese Konfigurationsisomere über das Lactaldehyd 1 miteinander im Gleichgewicht. Die Anteile der drei Spezies 2, 3 und 4 im Gleichgewichtsgemisch betragen 53,6 %, 38,6 % und 7,8 %. Die Geschwindigkeit der Gleichgewichtseinstellung ist sehr unterschiedlich. Ausgehend von Isomer 4 stellt sich das Gleichgewicht in Lösung nach etwa einem Monat ein, während ausgehend von Isomer 3 das Gleichgewicht in zwei bis drei Tagen erreicht wird.
Die drei dimeren Formen den Lactaldehyds entstehen jeweils durch die Reaktion eines D- und eines L-Monomers. Die Dimere aus zwei D- oder zwei L-Monomeren werden nicht beobachtet.
Im NMR-Spektrum der Gleichgewichtsmischung erhält man zusätzlich schwache Signale, die man einem Fünfring-Dimer zuordnen kann, sowie ein sehr schwaches Signal für das Aldehyproton des Monomers.
Einzelnachweise
- A. Wohl: Zur Kenntnis der Dreikohlenstoffreihe. In: Berichte der deutschen chemischen Gesellschaft. Band 41, Nr. 3, Oktober 1908, S. 3599, doi:10.1002/cber.19080410340.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von [No public or meaningful name is available] im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 6. Juli 2020.
- A. Wohl, M. Lange: Aufbau des Milchsäurealdehyds. In: Berichte der deutschen chemischen Gesellschaft. Band 41, Nr. 3, Oktober 1908, S. 3612, doi:10.1002/cber.19080410341.
- Externe Identifikatoren von bzw. Datenbank-Links zu Diethoxyacetaldehyd: CAS-Nummer: 5344-23-0, EG-Nummer: 807-284-2, ECHA-InfoCard: 100.234.849, PubChem: 219609, ChemSpider: 190379, Wikidata: Q82950805.
- Hermann O. L. Fischer, Erich Baer: Über Glyoxal-semiacetal. (II. Mitteilung über Glyoxal). In: Helvetica Chimica Acta. Band 18, Nr. 1, 1935, S. 514, doi:10.1002/hlca.19350180169.
- L. Hough, J. K. N. Jones: 773. The synthesis of sugars from simpler substances. Part IV. Enzymic synthesis of 6-deoxy-D-fructose and 6-deoxy-L-sorbose. In: Journal of the Chemical Society. 1952, S. 4052, doi:10.1039/jr9520004052.
- Hiroaki Takahashi, Yoko Kobayashi, Norio Kaneko: Conformational studies of DL-lactaldehyde by 1H-NMR, Raman and i.r. spectroscopy. In: Spectrochimica Acta Part A: Molecular Spectroscopy. Band 39, Nr. 6, Januar 1983, S. 569, doi:10.1016/0584-8539(83)80108-1.
