lac-Operon
Das Lactose-Operon, kurz lac-Operon, ist ein Operon (eine Funktionseinheit der Desoxyribonukleinsäure), das in Bakterien für Import und Abbau von Lactose eine wichtige Rolle spielt. Das lac-Operon, am Beispiel des Darmbakteriums Escherichia coli, ist eines der klassischen Modellsysteme der Genregulation. Hierbei wird ein extrazelluläres Signal, nämlich die Verfügbarkeit einer bestimmten Zuckerart, durch das Anschalten der Strukturgene des Operons in eine energetisch günstige Anpassung des Zellstoffwechsels übersetzt.
Aufbau des Operons
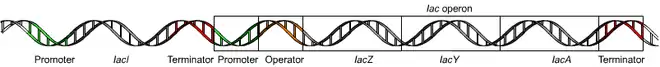
Das lac-Operon besteht aus einem Promotor (P), drei Operatoren (O1, O2 und O3) und drei Strukturgenen:
- Das lacZ-Gen codiert für das Enzym β-Galactosidase (LacZ, EC 3.2.1.23). Sie hydrolysiert, das heißt spaltet Lactose in Galactose und Glucose, kann aber auch Lactose in Allolactose, ein Isomer der Lactose umwandeln.
- Das lacY-Gen codiert für ein Transportprotein namens β-Galactosid-Permease (LacY), welches die Aufnahme von Lactose in die Zelle ermöglicht.
- Das lacA-Gen codiert für das Enzym β-Galactosid-Transacetylase (EC 2.3.1.18). Es ist nicht für den Lactoseabbau notwendig und seine Funktion ist nicht endgültig geklärt. Es gibt aber Hinweise darauf, dass die Acetylierung nichtabbaubarer β-Galactoside durch das Enzym eine Entgiftungsfunktion für die Zelle hat.[1]
Regulation des Operons
Diese drei Gene des lac-Operons werden erst dann exprimiert, wenn Lactose im Umgebungsmedium vorhanden ist und es keine für die Zelle günstigere Energiequelle gibt. Eine solche vorzuziehende Energiequelle ist z. B. die Glucose. Ein System aus negativer und positiver Regulation steuert den Abbau der effizientesten Energiequelle.
Das lac-Operon wird sowohl negativ durch einen Repressor, als auch positiv durch einen Aktivator reguliert. Zusätzlich kontrolliert der Mechanismus des Induktor-Ausschlusses (inducer exclusion) die Aktivität der Lac-Permease. Diese drei Regulationen bewirken, dass Lactose erst dann, wenn es keine effizientere Alternative gibt, verstoffwechselt werden kann.
Negative Regulation
Die negative Regulation des lac-Operons erfolgt auf Transkriptionsebene durch den Lac-Repressor. Der Repressor ist ein homotetrameres Protein, welches an jeweils zwei der Operatoren zugleich binden kann: O1 und O2 oder O1 und O3[2] Der Vorteil der negativen Regulation besteht darin, dass, solange keine Lactose verstoffwechselt werden muss, auch keine Enzyme für ihren Abbau bereitgestellt werden müssen. Die eigentliche Repression findet über die Bindung des Repressors an O1 statt. Die gleichzeitige Anlagerung an zwei Operatoren hat zur Folge, dass die zwischen den beiden Operatoren liegende DNA eine Schleifenform ausbildet. Dies wirkt sich auf die Stärke der Repression aus: Wenn der Repressor nur an O1 binden kann (in Mutanten, denen O2 und O3 fehlen), sinkt die Repression von etwa 1000-fach auf etwa 20-fach.[2] Falls er aber entweder an O1 als auch O2 (in Mutanten, denen O3 fehlt) bzw. an O1 als auch O3 (in Mutanten, denen O2 fehlt) gleichzeitig bindet, werden die Gene des Operons um die Faktoren 700 bzw. 440 reprimiert.
Der Grund für den Abfall der Expressionsrate liegt darin, dass die dafür notwendige RNA-Polymerase nicht mehr effizient an die DNA binden kann. Damit wird der Ablesevorgang des Gens, die Transkription, unterbunden.
Der Repressor wird von einem Regulatorgen, dem lacI-Gen, codiert. Dieses Gen liegt separat direkt vor dem lac-Operon (vgl. obiges Bild) und wird von einem eigenen, konstitutiven Promoter exprimiert. Da der Operator O3 mit dem 5'-Ende des lacI-Gens überlappt, kann es, wenn dieser Operator in einer DNA-Schleife mit O1 mit hoher Affinität von Lac Repressor gebunden wird, zu einer Behinderung der RNA-Polymerase kommen. Sie kann nicht mehr bis zum Ende des Gens gelangen und fällt von der DNA ab. Damit ist die mRNA des lacI-Gens unvollständig, es fehlt beispielsweise das Stopcodon. Wird die unvollständige RNA dann translatiert, bleiben Ribosomen hängen, da ohne Stopcodon die üblicherweise freisetzenden Faktoren der Termination (release factor RF) nicht wirksam werden. In der Bakterienzelle werden solche verharrenden Ribosomen durch tmRNA befreit (trans-Translation) und dabei das unvollständige LacI-Protein für den Abbau markiert.[3] Dieser Prozess der trans-Translation ist ein wichtiger Prozess in der Regulation des lac-Operons; ohne tmRNA entstünden unvollständige lacI-Repressoren, die immer noch teilweise aktiv wären.[4]
Positive Regulation
Verantwortlich für die positive Regulation des lac-Operons ist ein Aktivatorprotein: CAP (catabolite activator protein), der bestuntersuchte Effektor der Katabolitrepression. Die CAP-Aktivität ist direkt von der Konzentration des cAMP abhängig. Die Anlagerung von cAMP an CAP bewirkt eine Konformationsänderung in dem regulatorischen Protein, die seine spezifische DNA-Bindung stark erhöht. Der CAP-cAMP-Komplex lagert sich an eine Bindungsstelle der DNA an und interagiert von dort direkt mit der RNA-Polymerase. Dadurch wird die Affinität der RNA-Polymerase zum Promotor deutlich erhöht. Es sind also drei Elemente für diese positive Regulation des lac-Promotors notwendig: das CAP-Protein, cAMP und eine CAP-Bindungsstelle im lac-Promotor. Mutationen, die entweder zur Abwesenheit des CAP-Proteins oder zur Abwesenheit von cAMP oder zur Inaktivierung der CAP-Bindungstelle führen, haben den gleichen Effekt auf das lac-Operon. Seine Expression sinkt etwa 50-fach. Bei der Mutante lacUV5 ist die Katabolitrepression abwesend, weshalb sie für die Überexpression bakterieller rekombinanter Proteine verwendet wird.[5]
Einfluss der Lactose
Ist Lactose als Energielieferant das effizienteste Substrat in der Umgebung der Zelle, wird sie durch die β-Galactosidpermease in die Zelle gebracht. Dort wird sie teilweise durch β-Galactosidase in Allolactose umgewandelt. Dies bedeutet, dass die Gal-β-1,4-Glc-Bindung in eine Gal-β-1,6-Glc-Bindung überführt wird. In dieser Form ist nun eine Anlagerung an den Lac-Repressor möglich.
Durch diese Anlagerung verändert sich die Konformation des Repressors und er löst sich vom Operator. Nun kann die RNA-Polymerase mit der Transkription beginnen. Durch die nachfolgende Translation werden weitere Moleküle Permease und β-Galactosidase bereitgestellt. So kann Lactose dauerhaft als Substrat genutzt werden, bis dieses aufgebraucht ist oder eine bessere Energiequelle zur Verfügung steht.
Einfluss der Glucose
Für die Zelle ist es von Vorteil, Glucose anstatt Lactose als Substrat vorzuziehen. Folglich muss Glucose vor Lactose abgebaut werden. Damit dies geschieht, muss Glucose den Abbau von Lactose verzögern. Dies geschieht allerdings nicht direkt durch die Glucose selbst. Beim Transport der Glucose in die Zelle wird das Phosphotransferasesystem genutzt. Hierbei wird der Phosphatrest aus PEP über das Transportprotein E IIA auf die Glucose übertragen. Das unphosphorylierte E IIA hemmt nun die Lactose-Permease[6], wodurch keine Lactose in die Zelle transportiert wird und das lac-Operon inaktiviert bleibt. Dieser Vorgang wird als Induktorausschluss bezeichnet. So kommt es auch bei Anwesenheit von Lactose kaum zur Genexpression, und die Glucose wird bevorzugt abgebaut.
Viele Schulbücher führen eine Verringerung der cAMP-Konzentration als Grund für den Einfluss der Glucose auf die Expression des lac Operons an. Diese Annahme ist jedoch heute überholt. Es wurde festgestellt, dass die cAMP-Konzentrationen in Anwesenheit von Lactose etwa gleich ist wie in Anwesenheit von Glucose oder beider Zucker zugleich.[7][8]
Geschichte
1961 wurde von den französischen Wissenschaftlern François Jacob und Jacques Monod das Operon-Modell der Genregulation anhand des lac-Operons von Escherichia coli entwickelt.[9] Für diese Arbeiten erhielten sie 1965 den Nobelpreis für Physiologie oder Medizin.[10]
Besonderheiten des Lac-Operon
Generell wird Lactose im Dünndarm des Menschen aufgenommen, jedoch ist E. coli vor allem im Dickdarm zu finden. Infolgedessen steht Lactose als Nahrungsquelle normalerweise nicht oder nur in geringen Mengen für E. coli im Dickdarm zur Verfügung. Tatsächlich dient das Lactose-Operon eher dazu, Glyceryl-Galactoside abzubauen. Diese entstehen im Allgemeinen durch den Abbau aus Fetten tierischer Zellen und in diesem Fall, wenn die Zellen, die den Dickdarm auskleiden, abgestoßen werden und zerfallen. Glyceryl-Galactoside dienen hier sowohl als Induktor für das LacI-Protein (Repressor) und als Substrat für die β-Galactosidase, die Glyceryl-Galactoside in Glycerin und Galactose spaltet.
Weiterhin kann das Lac-Operon nicht in Salmonellen und verschiedenen anderen Darmbakterien (Enterobakterien), die relativ nah verwandt sind mit E. coli, nachgewiesen werden. Es ist wahrscheinlich, dass dieses Segment evolutionär gesehen relativ neu im E. coli-Genom ist und ursprünglich außerhalb der Enterobakterien entstand.[11]
Literatur
- Benno Müller-Hill (2001): Bacterial Transcription Regulation. In: Encyclopedia of Life Sciences. doi:10.1038/npg.els.0003828 PDF
- Agnes Ullmann (2001): Escherichia coli Lactose Operon. In: Encyclopedia of Life Sciences. doi:10.1038/npg.els.0000849 PDF
- Nancy Trun & Janine Trempy (2003): Gene Expression and Regulation. In: Fundamental Bacterial Genetics. ISBN 0-632-04448-9 PDF
- Robert Schleif (1993): Genetics and Molecular Biology. 2. Auflage, The Johns Hopkins University Press, Baltimore and London, ISBN 0-8018-4673-0.
- Wilhelm Seyffert (Hrsg.): Lehrbuch der Genetik. Spektrum Akademischer Verlag, Heidelberg und Berlin 2003, ISBN 3-8274-1022-3.
- Donald Voet, Judith G. Voet, Charlotte W. Pratt: Lehrbuch der Biochemie. Wiley-VCH, Weinheim 2002, ISBN 3-527-30519-X.
- David P. Clark: Molecular Biology. 1. Aufl. Elsevier Spektrum, Heidelberg 2006 S. 248, ISBN 978-3-8274-1696-4.
Einzelnachweise
- S.L. Roderick (2005): The lac operon galactoside acetyltransferase. In: C. R. Biologies Bd. 328, S. 568–575. PMID 15950163
- Santillán, M. und Mackey, MC. (2008): Quantitative approaches to the study of bistability in the lac operon of Escherichia coli. In: J R Soc Interface 6;5 Suppl 1:S29–39; PMID 18426771; PDF (freier Volltextzugriff, engl.)
- Keiler, KC. (2008): Biology of trans-translation. In: Annu Rev Microbiol. 62; 133–151; PMID 18557701; doi:10.1146/annurev.micro.62.081307.162948
- Abo, T. et al. (2000): SsrA-mediated tagging and proteolysis of LacI and its role in the regulation of lac operon. In: EMBO J. 19(14); 3762–3769; PMID 10899129; PMC 313975 (freier Volltext)
- A. E. Silverstone, R. R. Arditti, B. Magasanik: Catabolite-insensitive revertants of lac promoter mutants. In: Proceedings of the National Academy of Sciences. Band 66, Nummer 3, Juli 1970, S. 773–779, PMID 4913210, PMC 283117 (freier Volltext).
- Nelson S.O., Wright J.K. & Postma P.W. The mechanism of inducer exclusion. Direct interaction between purified IIIGlc of the phosphoenolpyruvate:sugar phosphotransferase system and the lactose carrier of Escherichia coli. In: EMBO J. Bd. 2, S. 715–720. PMC 555175 (freier Volltext)
- Inada T., Kimata K. & Aiba H. (1996): Mechanism responsible for glucose-lactose diauxie in Escherichia coli: challenge to the cAMP model. In: Genes Cells Bd. 1, S. 293–301. PMID 9133663
- Anthony JF Griffiths, Jeffrey H. Miller, David T. Suzuki, Richard C. Lewontin, William M. Gelbart: Catabolite repression of the lac operon: positive control. 2000 (nih.gov [abgerufen am 4. Januar 2018]).
- F. Jacob & J. Monod (1961): Genetic regulatory mechanisms in the synthesis of proteins. In: J. Mol. Biol. Bd. 3, S. 318–356. PMID 13718526
- Informationen der Nobelstiftung zur Preisverleihung 1965 an Francois Jacob und Jacques Monod (englisch)
- David P. Clark (2006): Molecular Biology, 1. Aufl. 2006, Elsevier GmbH, S. 248
Siehe auch
Weblinks
- Proteopedia: Lac repressor (engl.)