o-Nitrophenyl-β-D-galactopyranosid
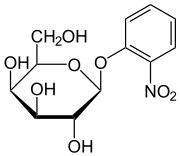
o-Nitrophenyl-β-D-galactopyranosid (ONPG) ist ein artifizielles Glycosid und chromogenes Substrat für β-Galactosidasen, z. B. das vom lacZ Gen von Escherichia coli codierte Enzym.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | o-Nitrophenyl-β-D-galactopyranosid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H15NO8 | ||||||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 301,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Bestimmte β-Galactosidasen hydrolysieren ONPG zu Galactose und dem gelben Farbstoff o-Nitrophenol.
Verwendung
In der Biochemie und mikrobiologischen Diagnostik wird ONPG zur qualitativen und quantitativen Bestimmung der Aktivität von β-Galactosidasen verwendet, siehe ONPG-Test.
Ein ausgezeichnetes Substrat der β-Galactosidase ist das Disaccharid Lactose. Ähnlich wie X-Gal, das für die qualitative β-Galactosidasebestimmung verwendet wird, ist ONPG ein Lactoseanalog, das für die β-Galactosidase ein chromogenes Substrat darstellt.
In einem Reaktionsansatz entstehen durch die hydrolytischen Spaltung des farblosen ONPG Galactose und das gelbgefärbte o-Nitrophenol. Um eine Reaktion pseudoerster Ordnung zu erhalten, muss ONPG im Überschuss im Ansatz vorhanden sein. Die Intensität der Gelbfärbung ist dann nur abhängig von der Konzentration der β-Galactosidase und der Reaktionsdauer. Durch Zugabe von Natriumcarbonat (Verschiebung des pH-Werts in den basischen Bereich (pH 11)) wird die Reaktion abgestoppt, da β-Galactosidasen, wie die meisten Enzyme, bei hohen pH-Werten inaktiv sind.
Die Menge des entstandenen o-Nitrophenols wird durch Absorption in einem Photometer bei 420 nm bestimmt. Aus der Reaktionsdauer, dem Absorptionswert und einem Wert für die eingesetzte Biomasse (Proteinkonzentration, Trübung der Bakterienkultur etc.) kann eine spezifische Aktivität der β-Galactosidase berechnet werden.
Literatur
- J. H. Miller Assay of β-Galactosidase, In: J.H. Miller Experiments in Molecular Genetics, S. 352–355, Cold Spring Harbor Laboratory, Cold Spring Harbor, 1972, ISBN 0-87969-106-9.
Einzelnachweise
- Datenblatt 2-Nitrophenyl-beta-D-galactopyranoside, 98+% bei AlfaAesar, abgerufen am 26. Dezember 2019 (PDF) (JavaScript erforderlich).