Schwarzbussard
Der Schwarzbussard (Buteogallus urubitinga) ist ein großer, mächtiger Greifvogel aus der Gattung Buteogallus innerhalb der Unterfamilie der Bussardartigen (Buteoninae). Die fast gänzlich schwarze Art mit breiten, gerundeten Flügeln und einem kurzen, gebänderten Schwanz kommt von den Küstenbereichen Mexikos und Mittelamerikas, über das gesamte ostandische Südamerika, südwärts bis Nordargentinien vor. Westlich der Anden bestehen nur wenige Verbreitungsgebiete in Kolumbien, Ecuador und dem nördlichen Peru. Die Geschlechter sind weitgehend gleich gefärbt; Weibchen sind nur unmerklich größer, aber bis zu 28 % schwerer als Männchen.[1] Jungvögel unterscheiden sich mit ihrer braunen Oberseite und der auf hellem Grund braun gesprenkelten Bauchseite deutlich von adulten Schwarzbussarden.
| Schwarzbussard | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
_(29128108436).jpg.webp)
Adulter Schwarzbussard | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Buteogallus urubitinga | ||||||||||||
| (Gmelin, 1788) |
Die meisten Populationen scheinen Standvögel zu sein, doch deutet die Anwesenheit sehr großer, südlicher Vögel während des südlichen Winters in Kolumbien auch auf regelmäßige Wanderbewegungen hin.[1] Buteogallus urubitinga ist ein ausgesprochener Nahrungsgeneralist, der sich von solchen Beutetieren ernährt, die sich am leichtesten erbeuten lassen und den größten Energiegewinn versprechen; Reptilien, darunter auch hochgiftige Schlangen und Amphibien, spielen aber immer eine prominente Rolle.
Die Art ist in manchen Regionen (Venezuela, Guayana) ein häufiger, im Großteil des riesigen Verbreitungsgebietes aber nur ein eher seltener, sehr lückenhaft verbreiteter Brutvogel. Obwohl in manchen Gebieten Entwaldung zum Verlust von Brutplätzen führt, ist die Art flexibel genug, um sich geänderten Lebensbedingungen anzupassen; sie wird deshalb von BirdLife International in keiner Gefährdungsstufe geführt (LC = Least Concern).[2]
Buteogallus urubitinga wurde 1788 von Johann Friedrich Gmelin anhand eines Typusexemplars aus Nordostbrasilien als Falco urubitinga erstbeschrieben. Das Artepitheton ist der Sprache der indigenen Tupí entlehnt und bedeutet "Großer schwarzer Vogel".[3] Mit Stand Ende 2019 werden zwei gut differenzierte Unterarten anerkannt.[4]
Aussehen
_(8079375737).jpg.webp)
.jpeg.webp)
_immature.JPG.webp)

Der Schwarzbussard ist ein massiger, kräftig gebauter, weitgehend schwarzer Greifvogel mit sehr breiten, gerundeten Flügeln, einem vergleichsweise kurzen Schwanz und langen Beinen. Im Sitzen überragt der Schwanz deutlich die Flügel, im Flug jedoch erscheint er annähernd in die Flügel eingebettet zu sein. Kennzeichnend sind die weißen Unterschwanzdecken und ein breites weißes Band gegen Ende der basalen Hälfte des weiß gerandeten Schwanzes. In vielen Flugpositionen kann ein markanter Flügelbug auffallen. Der Schwarzbussard fliegt mit langsamen, tief durchgezogenen Flügelschlägen und segelt mit annähernd waagrecht gehaltenen Flügeln. Häufig ist er laufend oder auch flughüpfend am Boden zu sehen. Die Geschlechter sind gleich gefärbt; der reverse Größendimorphismus ist mit 5 % – 7,2 %[1][5] nicht wesentlich, wohl aber der reverse Gewichtsdimorphismus mit im Durchschnitt deutlich über 20 %.[1] Der Überschneidungsbereich ist aber so groß, dass feldornithologisch eine sichere Geschlechtsbestimmung nur aus Verhaltensmerkmalen möglich ist. Die Größe schwankt zwischen 51 – 64 Zentimetern; das Gewicht der Männchen liegt im Durchschnitt bei 1135, das der Weibchen bei 1457 Gramm. Die Spannweite großer Weibchen kann 137 Zentimeter erreichen. Vögel der südlichen Nominatform sind im Durchschnitt größer und schwerer.[6][4][1]
Wesentlichster Verwechslungspartner ist der Krabbenbussard (etwas kleiner, keine weißen Unterschwanzdecken, deutliches Medialband) und in manchen Gebieten der Einsiedleradler, der wesentlich größer ist und ebenfalls keine weißen Unterschwanzdecken aufweist. Jungvögel können mit einer Reihe anderer juveniler Vögel aus der Unterfamilie der Bussardartigen verwechselt werden.[1]
Erwachsenengefieder
Das gesamte Körpergefieder von Vögeln der Nominatform ist weitgehend ungezeichnet schwarz, manchmal weist es einen leichten schwarzbräunlichen Ton auf. Die Unterschwanzdecken sind weiß, ebenso fast die gesamte basale Hälfte des schwarzen Schwanzes. Das feine weiße Terminalband kann bei stark abgetragenem Gefieder (teilweise) fehlen. Die langen Beine sind bis zum Intertarsalgelenk meist völlig ungezeichnet schwarz gefiedert (seltener sind vereinzelte weiße Punkte oder Striche festzustellen); die Laufbeine sind gesättigt gelb, ebenso die relativ kurzen Zehen. Der mächtige Hakenschnabel ist im basalen Drittel von einer gelben Wachshaut überzogen, der Rest ist dunkel schiefergrau. Ein gelber Zügel kann aus der Nähe erkannt werden. Die Iris ist kastanien- bis rotbraun. Die Flügel sind mit zweifacher Körperlänge für einen Greifvogel kurz, sie sind gebuchtet und insgesamt sehr breit. Auf der Oberseite sind sie ungezeichnet schwarz, auf der Unterseite sind die Armschwingen sehr dezent heller gebändert (dieses Merkmal ist nur bei Hintergrundlicht erkennbar). An der Basis der äußersten Handschwingen zeigt sich oft ein länglicher hellerer Fleck. Deutlich sind im Flug der weiße Bürzel und die weiße Schwanzzeichnung.[4]
Die Unterart B. u. ridgwayi unterscheidet sich neben der durchschnittlich geringeren Größe vor allem durch eine unterschiedliche Zeichnung der Beinbefiederung und des Schwanzes. Die gefiederten Teile des Beins sind auf schwarzem Grund oft sehr markant weiß gepunktet und gefleckt oder aber undeutlich grau gebändert. Die Unterflügeldecken sind meist deutlich weiß gepunktet. Der Schwanz weist an der Basis ein schmales und in der Mitte ein breites weißes Band auf. Er ist, wie bei B. u. urubitinga, an seinem Ende von einem schmalen, weißen Band begrenzt. Die Wachshaut wird bei Ferguson-Lees als schiefergrau beschrieben, bei Gerhardt aber als gelb. Der Zügel ist unauffällig schiefergrau.[1][7]
Jugendgefieder und Mauser
Die Küken beginnen mit etwa 15 Tagen ins erste Jugendgefieder zu mausern, das sie beim Ausfliegen (mit noch nicht voll entwickelten Großfedern) tragen. Bis auf den hellen, nur spärlich dunkel strähnig gezeichneten Kopf ist das gesamte Oberseitengefieder braun. Der obere Rückenbereich ist intensiv hell gesträhnt, die Oberseitendecken und Schulter hellbraun gefleckt. Die Unterseite ist auf cremeweißem Grund deutlich dunkelbraun gefleckt. Die Unterflügeldecken sind unregelmäßig braun gefleckt oder getropft. Die Füße sind hellgelb, die Wachshaut ist gelblich und die Iris ist braun. Dieses Gefieder vermausern sie im nächsten Frühjahr in das erste Immaturgefieder, das weitgehend dem Jugendgefieder gleicht, jedoch insgesamt (vor allem auf der Oberseite) dunkler ist und weniger Zeichnungen aufweist. Auffällig ist ein cremefarbener Überaugenstreif. Der Schwanz ist bereits weiß begrenzt; er weist auf bräunlichem Grund auf Ober- und Unterseite einige dunkle Bänder auf. Die Unterseite der Schwingen ist schiefergrau mit nur undeutlicher dunklerer Bänderung. Die Mauser in das zweite Immaturgefieder beginnt im Jahr darauf. Dieses gleicht weitgehend dem Erwachsenengefieder, zeigt insgesamt aber eine stärkere dunkelbraune Tönung. Der Kopf, die Brust und die Unterflügeldecken zeigen unregelmäßig angeordnete Strähnen und Flecken, einige der inneren Handschwingen sind oft deutlich rehbraun gebändert. Die Schwanzzeichnung ist variabel: Häufig ist er so wie im ersten Immaturgefieder gefärbt, oder er ist deutlich (manchmal wellig) 2 – 4 mal weiß (Oberseite), beziehungsweise cremefarben (Unterseite) gebändert. Im darauffolgenden Jahr erfolgt die Mauser in das definitive Erwachsenengefieder, die sich jährlich wiederholt. Es werden aber nicht in jedem Zyklus alle Großfedern gewechselt.[8]
Stimme
Schwarzbussarde sind akustisch sehr auffallende Vögel, auch außerhalb der in dieser Hinsicht besonders intensiven Vorbrutzeit. Hauptruf ist ein eigenartig langsamer, langgezogener, gepresst wirkender Ruf mit fast technischer, maschineller Anmutung. Er setzt plötzlich ein und klingt ansteigend aus. Dieser Ruf ist von beiden Partnern sowohl im Flug als auch sitzend zu hören; er scheint als universaler Anwesenheits- und Kommunikationsruf zu dienen.[9] Auf größere Erregung deuten sehr schnell gereihte, kurze, hohe Ruffolgen hin.[10]
Verbreitung und Lebensraum
Brutgebiet
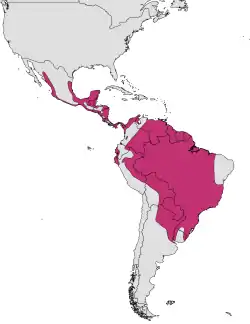
Die nördlichsten Brutvorkommen liegen in den nördlichen Provinzen Mexikos (Sonora und Tamaulipas), sowohl an der pazifischen als auch an der Golfküste. Südwärts ist die Halbinsel Yucatán sowie Mittelamerika an beiden Küstenbereichen Brutgebiet. Das gebirgige Binnenland ist hier, wie auch in Mexiko, nicht besiedelt. (Ob dies für alle Binnenregionen Mexikos gilt, ist zweifelhaft: Schwarzbussarde wurden regelmäßig im Osten des Bundesstaates Morelos beobachtet.[11]) Im nördlichen Südamerika brütet die Art an der karibischen Küste Kolumbiens und im Tiefland rund um den Maracaibo-See in Venezuela. In den fast an die Küste reichenden Ausläufern der Anden und den östlich daran anschließenden Küstengebirgen ist der Schwarzbussard kein Brutvogel. Nach dieser Verbreitungslücke beginnen geschlossene Vorkommen, die den gesamten nördlichen Küstenbereich Südamerikas und das Amazonasbecken umfassen. Nach Westen ist es durch den Hauptkamm der Anden begrenzt, nach Osten durch den Atlantischen Ozean. Südlich des Amazonasbeckens reichen die Brutvorkommen im Westen bis Nordwestargentinien im Osten bis zur Mündung des Río de la Plata, in dessen Tiefländern auch der Schwerpunkt der südamazonischen Verbreitung der Art liegt. Der Schwarzbussard brütet auf Tobago und in geringer Zahl auf Trinidad. Ob die Art entlang des Río Magdalena oder des Río Meta ins Binnenland Kolumbiens vordringt, ist nicht bekannt.
Westlich der Anden kommt die Art an mehreren pazifischen Küstenabschnitten Kolumbiens und etwas ausgedehnter entlang der Pazifikküste Zentral- und Südecuadors (vom Golf von Guayaquil und Puná) südwärts bis Nordperu vor.[1]
Lebensraum

Der Schwarzbussard ist nicht in dem Maße an wasserdominierte, aquatische Lebensräume gebunden wie etwa der Krabbenbussard, doch sind Wasserläufe, dauernd oder zumindest zeitweise vernässte Gebiete und, in geringerem Maße, Meeresküsten seine bevorzugten Lebensräume; wichtig ist ein (relativ dichter) Baumbestand mit einzelnen Überständern und Freiflächen als Jagdgebiete. Generell ist er in direkter Küstennähe seltener als der Krabbenbussard, jedoch häufiger als dieser im bewaldeten Hinterland. Er kann sehr unterschiedliche Lebensräume wie Mangrove, Galeriewälder, tropischen und atlantischen Regenwald (vor allem Randgebiete mit natürlichen Lichtungen oder Uferregionen, beziehungsweise Übergangszonen zum Cerrado), sogenannte Bajos, temporär vernässte Waldgebiete sowie Feuchtgebiete wie das Pantanal als Lebensraum nutzen, kann aber auch nur saisonal feuchte Llanos, baumbestandene Feuchtsavannen und subtropischen Trockenwald besiedeln. Selbst Bergregionen mit Kiefern und Eichenbeständen (etwa die Sierra de los Tuxtlas)[12] oder relativ trockene Landschaften, wie Caatinga und im Extrem Saguaro-Bestände, können ein geeignetes Bruthabitat sein, solange Wasser nicht zu weit entfernt ist. Stark anthropogen verformte Gebiete meidet er, in extensiv genutzten, baumbestandenen Weideland oder in Gebieten, in denen Wanderfeldbau betrieben wird, kommt er jedoch als Brutvogel vor. Auch abgeerntete Zuckerrohrfelder nutzt er als Jagdgebiet.[13][1][14] Vor allem im dichten, geschlossenen Regenwald sind die Ränder aufgegebener Feldbauinseln oder nachwachsender Sekundärwald in früher Sukzession wichtige Mikrohabitate.[14]
Der Schwarzbussard ist vor allem ein Brutvogel der Tieflandgebiete und der Hügelländer. Unter 500 Meter über NHN liegt der Schwerpunkt seiner Brutverbreitung. Gebietsweise (Mexiko, Kolumbien) wurde er in Höhen bis zu 1200 Metern festgestellt, in Mittelamerika auch bis zu 1900 Metern.[1]
Ferguson-Lees gibt eine Verbreitungsdichte von zumindest 17 Brutpaare/100.000 km² an. Stellenweise (Guyanas) kann sie jedoch bedeutend höher sein.[1] Gerhardt et al. errechneten für das 576 km² große Schutzgebiet auf Yucatán 26 – 32 Brutpaare. Der durchschnittliche Nestabstand betrug 4,46 Kilometer.[15] Eine wesentlich dünnere Verbreitung ergab eine Linienkartierung in einer Bergregion in Veracruz; dort betrug der durchschnittliche Abstand zwischen zwei Sichtungen 44,8 km.[12] Aufgrund der späten Brutreife befindet sich immer eine nicht unbeträchtliche Anzahl von Jungvögeln und Immaturen in einem Gebiet, deren Erfassung jedoch sehr schwierig ist.[16]
Zumindest der unmittelbare Nestbereich wird von beiden Altvögeln energisch verteidigt. Schlangen versuchen die Altvögel abzulenken und so vom Nest fernzuhalten, Affen (z. B. Klammeraffen) und Greifvögel (auch wesentlich größere aus der Gattung Spizaetus) werden direkt angeflogen. Auch Braunflügelguane duldet ein Schwarzbussardpaar nicht in Nestnähe.[17]
Wanderung
Der Schwarzbussard gilt in seinem gesamten Verbreitungsgebiet als Standvogel; regelmäßige Wanderungen wurden bislang nicht bekannt. Wie gelegentliche Sichtungen großer, südlicher Schwarzbussarde in nördlichen Regionen (Kolumbien, Panama) zu verstehen sind, ist ebenso unklar wie Nachweise von Vögeln der Unterart B. u. ridgwayi im Departamento del Chocó. Außerbrutzeitlich wurden Schwarzbussarde auch südlich des bekannten Brutgebietes in der argentinischen Provinz Buenos Aires festgestellt. Ebenfalls unbekannt ist das Dismigrationsverhalten juveniler und immaturer Schwarzbussarde.[1][4]
Nahrung und Nahrungserwerb
.jpg.webp)

_diving_for_a_piranha_thrown_in_the_water_by_our_boatman_..._(30958991413).jpg.webp)
Der Schwarzbussard ist ein äußerst flexibler Prädator. Er nutzt praktisch alle Lebewesen seines Lebensraumes, die er überwältigen kann und die ein entsprechend günstiges Verhältnis zwischen Aufwand und Energiegewinn aufweisen. Alle zur Verfügung stehenden Untersuchungen zeigen, dass Reptilien und Amphibien die wesentlichsten Nahrungskomponenten sind. Daneben erbeutet der Schwarzbussard in nicht unbeträchtlicher Anzahl kleine und mittelgroße Säugetiere, Vögel, Fische und Insekten.[1] Im südlichen Mato Grosso brachten Schwarzbussarde bevorzugt Schlangen (Bothrops sp., immer ohne Kopf, auch sehr große Arten wie Hydrodynastes gigas) sowie unterschiedliche Echsen, Froschlurche (vor allem Echte Kröten, von denen nur die Eingeweide oder die Hinterbeine gefressen wurden), Vögel (Picazurotaube, Schleiereule) sowie unterschiedliche Säugetiere (Fledermäuse, Neuweltmäuse, Weißohropossums, Schwarzbüschelaffen) und regelmäßig Insekten (vor allem große Arten) zum Nest.[18][14]
Die umfangreiche Studie im Tikal - Regenwald auf Yucatán in Guatemala zeigte eine große Vielzahl an Reptilien als wichtigste Beutetiere, während hier Amphibien, im Gegensatz zu Costa Rica und Südostbrasilien, nur eine geringe Rolle spielten. Besonders häufig wurden baumbewohnende Leguane aus den Gattungen Basiliscus und Anolis sowie Schlangen (Oxybelis sp. und junge Boa constrictor, aber auch giftige Arten, wie Lanzenottern) erbeutet. Unter den Säugetieren waren die Mehrzahl Streifenhörnchen und andere Nagetiere (zum Beispiel Großohr-Kletterratten), verschiedene Arten von Opossums und Fledermäusen. Die vielfältige Vogelbeute umfasste Nestlinge und Eier relativ großer Arten sowie unter anderen adulte Tukane, Tauben, Drosseln, Spechte und Pirole. Insekten wurden regelmäßig erbeutet; sie spielen in Hinblick auf die Biomasse keine Rolle. Fische wurden in dieser Untersuchung nicht festgestellt, können aber anderswo zu den wichtigen Beutetieren zählen.[19]
Der Schwarzbussard verwertet auch Kadaver, insbesondere Beutereste von Krokodilen, und sammelt überfahrene Tiere, vor allem Schlangen, auf. Selten wurden Schwarzbussarde beim Verzehr von Früchten beobachtet.[1]
Entsprechend der großen Vielfalt an Beutetieren wendet der Schwarzbussard unterschiedliche Jagdmethoden an, von denen die systematische Suchjagd mit kurzen Flügen von Baum zu Baum, mit jeweils kurzen Ansitzphasen, die wichtigste ist. Dabei versucht er sowohl bodenlebende Arten wie auch Baumbewohner aufzuspüren oder zu überraschen. Sitzende Vögel, baumkletternde Schlangen und Basilisken greift er direkt von Baumstämmen oder Ästen; Vögel erbeutet er auch im Flug oder fliegt aggressiv in Brutkolonien von Ibissen, Reihern oder Stärlingen, um die Altvögel von den Nestern zu vertreiben und so an Eier oder Nestlinge zu gelangen. Vor allem Stärlingskolonien können von Schwarzbussarden vollkommen zerstört werden.[20] Bodenbewohner schlägt er aus dem Flug heraus oder indem er fast lautlos und nahezu ohne Flügelschlag von einem Ansitz gleitet. Längere Ansitzphasen sind vor allem an wasserzugewandten Stellen zu beobachten, wenn er auf oberflächennah schwimmende oder treibende Fische lauert, die er in der Art von Seeadlern im Überflug mit vorgestreckten Beinen zu ergreifen sucht. Häufig ist der Schwarzbussard auf der Jagd nach Reptilien und Amphibien am Boden zu sehen, wo er aufgescheuchte, fliehende Tiere laufend oder flughüpfend verfolgt. Ebenso watet er im Gezeitensaum auf der Suche nach Krabben oder sucht in den langsam während der Trockenperioden austrocknenden Tümpeln nach dort gefangenen Fischen.[20] Schwarzbussarde wurden bei gemeinschaftlicher, paarweiser Jagd beobachtet. Wie andere Greifvögel fliegen sie oft weite Strecken, um entlang der Brandkanten von Buschfeuern fliehende, oder bereits verendete Tiere aufzusammeln.[1][4]
Unter den Beutetieren des Schwarzbussards sind sehr viele nachtaktive Tiere. Offenbar sind diese in ihrer Ruhephase am Tag eine mit vergleichsweise geringem Aufwand zu schlagende Beute.[21]
Brutbiologie
Das Bruteintrittsalter ist nicht genau bekannt; da aber immer voll ausgefärbte Individuen brüten, stehen sie bei ihrer ersten Brut zumindest im dritten, wahrscheinlich häufig im vierten Lebensjahr. Aufgrund der sehr langen Führungszeit dürfte es nur eine Jahresbrut geben, doch stehen genaue Daten ebenso wenig zur Verfügung wie über Ersatzgelege bei Gelegeverlust.[22] Der Brutbeginn liegt in der späten Trockenzeit. Auf Yucatán ist dies von Ende März bis Anfang Mai (dies gilt wahrscheinlich auch für das restliche Mittelamerika und das südliche Mexiko), etwa einen Monat früher in Panama. In Venezuela und Suriname wurden zwischen Juni und November frische Gelege festgestellt, zwischen April und Mai auf Trinidad. Ab Ende September/Anfang Oktober ist Brutbeginn im südöstlichen Brasilien und nördlichen Argentinien.[4][1][18]
Auch über Art und Dauer der Paarbindung fehlen Informationen. Die Sesshaftigkeit der Art, ihre große Reviertreue und die lange Unselbständigkeit der Jungen lassen jedoch mehrjährige Paarbindungen vermuten.[23]
Paarbildung, Neststandort und Nest
Das Balzverhalten ist noch nicht im Detail dokumentiert, doch sind gemeinsames Kreisen über dem Brutgebiet, Ausdrucksflüge, Flugakrobatik sowie eine markante vokale Präsenz Elemente der Paarbindung.
Das Nest wird fast immer in das übrige Kronendach überragenden, hohen Bäumen unterschiedlicher Art (Kapokbaum, Schwarzer Olivenbaum, Amerikanisches Mahagoni, Phyllostylon sp.) in einer Gabelung eines starken Seitenastes errichtet. In Guatemala lagen die durchschnittlichen Höhen zwischen 20 und 31 Metern. Es ist eine sehr stabile Plattform aus frischen Ästen, die außen mit frischen, belaubten Zweigen getarnt und innen mit Laub und frischen Zweigchen ausgepolstert wird. Die Nistmulde ist nur wenig vertieft. Häufig wird es zusätzlich mit Ranken von Kletterpflanzen getarnt und stabilisiert. Die Außen- und Innenauskleidung wird während der gesamten Brutzeit regelmäßig erneuert. Oft werden Nester anderer Greifvögel adaptiert sowie alte eigene Nester erneuert und erweitert. Ein neues Nest hat etwa einen Durchmesser von 83 Zentimetern und ist 56 Zentimeter hoch; bei mehrmaliger Verwendung werden die Nester jedoch wesentlich umfangreicher.[4] In Argentinien wurden Nester auch auf Telegrafenmasten errichtet; oft wird dort Nistmaterial von Nestern des Mönchssittichs verbaut oder dessen gesamtes Nest als Basis für das eigene Nest verwendet.[1]
Gelege und Jungenaufzucht
Soweit bisher bekannt, besteht das Gelege immer nur aus einem Ei. (Davon abweichend existiert die Beobachtung einer Familiengruppe mit 2 Jungen in Mexiko[24], die nahelegt, dass gelegentlich auch größere Gelege zustande kommen). Die weißlichen, lila oder rotbraun gefleckten Eier der Unterart B. u. urubitinga sind relativ größenvariabel mit mittleren Maßen von 62,4 × 52,1 Millimeter. Das durchschnittliche Gewicht von Eiern der Nominatform betrug 72,8 Gramm.[24][14] Ein in Nordargentinien vermessenes Ei war ähnlich groß, wog aber 82,0 Gramm.[18] Ein vermessenes Ei der Unterart B. u. ridgwayi maß 47,5 × 59 Millimeter. Es wird mehrheitlich vom Weibchen 35 – 40 Tage bebrütet (zwei Bruten in Argentinien 35 bzw. 36 Tage, eine Brut in Guatemala 40 Tage).[14][4] Futterübergaben an das Weibchen wurden in dieser Zeit nicht beobachtet; offenbar besorgt sich das Weibchen seine Nahrung selbständig.[25] Das Junge schlüpft mit einem auf der Bauchseite cremefarbenen, am Rücken dunkelbräunlichen Dunenkleid. Es ist nicht imstande zu sitzen und kann den Kopf nur zur Nahrungsaufnahme etwas anheben.[26][27] Im detailliert untersuchten Brutgebiet auf Yucatán besorgte das Männchen etwa bis zum 27. Nestlingstag die gesamte Nahrung, die es entweder in einem nahen Baum ablegte oder direkt zum Nest brachte. Am Nest wurde es nur kurze Zeit geduldet. Ab diesem Zeitpunkt (das Junge war mitten in der Mauser ins erste Jugendgefieder, konnte zwar Beutetiere schon selbstständig zerlegen, brauchte jedoch noch Assistenz beim Fressen) beteiligte sich das Weibchen mehr und mehr an der Nahrungsbeschaffung, bis es im letzten Drittel der Nestlingszeit den überwiegenden Teil (76 %) der Nestlingsnahrung zum Nest brachte.[25] Erst mit 42 Tagen beginnt das Junge selbstständig zu fressen und klettert bald danach für kurze Zeitspannen ins nahe Geäst. Der erste kurze Flugversuch wurde im Alter von 61 Tagen beobachtet.[27] Der Jungvogel ist nach dem Verlassen des Nestes eingeschränkt flugfähig. Er bleibt für die ersten Wochen im oder nahe dem Brutbaum und ist vollkommen von den Altvögel abhängig. Diese Abhängigkeitsperiode dauert zumindest 7 Monate, wahrscheinlich aber bis zu einem Jahr.[4]
Systematik
Buteogallus urubitinga wurde 1788 von Johann Friedrich Gmelin als Falco urubitinga erstbeschrieben.[28] Das Typusexemplar stammt aus dem Nordosten Brasiliens.[4] Gmelin griff mit urubitinga auf eine Bezeichnung zurück, die schon 1648 Georg Marggraf und 1760 Mathurin-Jacques Brisson für einen großen, schwarzen brasilianischen Greifvogel verwendet hatten.[29] Nach der Erstbeschreibung waren unterschiedliche Artnamen und Gattungszuordnungen gebräuchlich (Falco longipes, Morphnus urubitinga, Spizaetus niger, Harpyia urubitinga und andere).[30] Die Gattungen Hypomorphnus und Urubitinga wurden bis zur Mitte des 20. Jahrhunderts am häufigsten verwendet. Kritik an der Sonderstellung von Hypomorphnus/Urubitinga urubitinga regte sich vor allem deshalb, weil der Krabbenbussard, der (irrigerweise) als der nächste Verwandte galt, der Gattung Buteogallus angehörte. 1955 schlugen Dean Amadon und Don R. Eckelberry vor, den Schwarzbussard in die Gattung Buteogallus zu stellen;[31] diesem Vorschlag folgten nach und nach alle wesentlichen Autoritäten.
Buteogallus urubitinga steht gemeinsam mit Buteogallus lacernulatus, Buteogallus solitarius und Buteogallus coronatus in einer Klade.[4] Die beiden letzten wurden erst 2012 von Harpyhaliaetus nach Buteogallus gestellt.[32] Mit Stand Anfang 2020 werden zwei gut differenzierte Unterarten anerkannt, für die verschiedentlich auch Artrang vorgeschlagen wurde. Allerdings hybridisieren die beiden Unterarten im Osten Panamas.[4]
- Buteogallus urubitinga urubitinga (Gmelin, 1788): Nordostpanama bis Nordargentinien.
- Buteogallus urubitinga ridgwayi (Gurney, sen., 1884): Mittelamerika und Mexiko.
Bestand und Bedrohung
Es sind nur wenige regionale Untersuchungen zur Bestandsquantifizierung und Populationsdynamik verfügbar. Überregionale Analysen fehlen vollkommen. BirdLife stellt zwar einen Bestandsrückgang fest, bewertet jedoch die Bestandssituation der Art mit LC (=least concern). Als Gründe für diese Einschätzung werden das sehr große, über 20 Mio. km² umfassende Verbreitungsgebiet sowie die mit max. 5 Mio. Individuen (Minimalschätzung 500.000) noch immer erhebliche Anzahl von Individuen angegeben.[2]
Der Schwarzbussard wird als vergleichsweise tolerant gegenüber Störungen und Beeinträchtigungen seines Lebensraumes angesehen,[2] doch trifft diese Auffassung auch auf Widerspruch. Gerhardt et al. stellten die Mehrzahl der aktiven Horste in ungestörten Primärwäldern fest. So scheinen Habitatsverlust durch Brandrodung und Umwandlung von als Jagdgebiet genutzten Lagunen in Shrimpsfarmen die substanziellsten Bedrohungsfaktoren darzustellen.[33]
Literatur
- R. O. Bierregaard Jr., P. Boesman und G. M. Kirwan: Great Black Hack (Buteogallus urubitinga). In: J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, und E. de Juana (Hrsg.): Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona 2019 (heruntergeladen von https://www.hbw.com/node/53113 am 25. Dezember 2019)
- James Ferguson-Lees, David A. Christie: Raptors of the World. Houghton Mifflin, Boston 2001, ISBN 0-618-12762-3, S. 990; S. 632 – 634.
- J. van Dort: Great Black Hawk (Buteogallus urubitinga) In: Neotropical Birds Online (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA 2019. Heruntergeladen von https://doi.org/10.2173/nb.grbhaw1.01 am 25. Dezember 2019
- Richard P. Gerhardt, Nathaniel E. Seavy und Ricardo E. Madrid: Great Black Hawk In: David F. Whitacre (Hrsg.): Neotropical Birds of Prey: Biology and Ecology of a Forest Raptor Community. Cornell University Press Ithaka NY 2012, S. 139 – 152 ISBN 978-0-8014-4079-3 - und Kindle version (ohne Seiten).
Einzelnachweise
- James Ferguson-Lees, David A. Christie: Raptors of the World. Houghton Mifflin, Boston 2001, ISBN 0-618-12762-3, S. 990; S. 632 – 634.
- BirdLife International (2019) Species factsheet: Buteogallus urubitinga. Heruntergeladen von BirdLife factsheet am 25. Dezember 2019
- James A. Jobling: The Helm Dictionary of scientific Bird Names. Christopher Helm, London 2010. ISBN 978-1-4081-2501-4
- R. O. Bierregaard Jr., P. Boesman und G. M. Kirwan: Great Black Hack (Buteogallus anthracinus). In: J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, und E. de Juana (Hrsg.) Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona 2019
- Richard P. Gerhardt, Nathaniel E. Seavy und Ricardo E. Madrid: Great Black Hawk In: David F. Whitacre (Hrsg.): Neotropical Birds of Prey S. 140
- J. van Dort: Great Black Hawk (Buteogallus urubitinga) In: Neotropical Birds Online (T. S. Schulenberg, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA 2019. Appearance
- Gerhardt et al. S. 140
- Steve N. G. Howell und Sophie Webb: A Guide to the Birds of Mexico and Northern Central Amerika. Oxford University Press 1995 (Auflage 2005) ISBN 978-0-19-854012-0 Tafeln: 4, 8, 10, 11; S. 193 – 194
- xeno-canto: Kommunikationsruf
- xeno-canto: Ruffolge
- Fernando Urbina-Torres: New distributional information of birds from the State of Morelos, Mexico. In: Bulletin of the British Ornithologists' Club. Jhrg. 120; Folge 1; 2000. S. 8 – 15 BHL
- Eduardo Iñigo, Mario Ramos und Fernando Gonzalez: Some Ecological Aspects of two Primary Evergreen Forest Raptor Communities compared with Cultivated Tropical Areas in Southern Mexico. In: Raptors in the Modern World; Meyburg, B.-U. & R. D. Chancellor hrsg. 1989. S. 529 – 533
- Gerhardt et al. S. 139
- The Peregrine Fund Global Raptor Information Network Buteogallus urubitinga
- Gerhard et al. (Kindle Version - ohne Seiten) Inter-nest Spacing and Density of Territorial Pairs
- Nathaniel E. Seavy und Richard P. Gerhardt: Breeding Biology and Nestling Diet of the Great Black-Hawk. In: The Journal of Raptor Research. Jhrg. 32; Folge 2; 1998. S. 173 – 175 BHL
- Gerhardt et al. (Kindle version ohne Seiten) Nest Defense and Interspecific Interactions
- Eduardo Pio M. Carvalho Filho, Marcus Canuto und Giancarlo Zorzin: Biologia reprodutiva e dieta do gavião preto (Buteogallus u. urubitinga: Accipitridae) no sudeste do Brasil.In: Revista Brasileira de Ornitologia Jhrg. 14; Folge 4; S. 445 – 448. pdf port.
- Gerhardt et al. S. 141
- Scott K. Robinson: Habitat Selection and Foraging Ecology of Raptors in Amazonian Peru. In: Biotropica, Jhrg. 26, Folge 4; 1994, Seiten: 443 – 458.
- Gerhardt et al. S. 141
- Gerhardt et al. (Kindle-Version ohne Seiten) Breeding Biology
- Gerhardt et al. (Kindle-Version ohne Seiten) Constancy of Territory Occupancy...
- Gerhardt et al. (Kindle-version ohne Seiten) Egg and Clutch Size
- Gerhardt et al. (Kindle-version ohne Seiten) Behavior of Adults
- Gerhardt et al. (Kindle version ohne Seiten) Morphologie
- Gerhardt et al. (Kindle version ohne Seiten) Nestling Period
- Caroli a Linné: Systema naturæ per regna tria naturæ, secundum classes, ordines, genera, species; cum characteribus, differentiis, synonymis, locis. Editio decima tertia (Cura Jo. Frid. Gmelin) Erstbeschreibung
- Ernst Walter Mayr und George William Cottrell, Jr. (Hrsg.): Check-list of birds of the world Bd. 1, 2. Ausgabe 1979. BHL
- George Robert Gray: Nomenclature of Birds. Unpublished (~1851) S. 20 BHL
- Dean Amadon und Don R. Eckelberry: Obvervations on Mexican Birds. In: The Condor Jhrg. 57, Nr. 2 (1955) S. 68 pdf engl.
- R. Terry Chesser et al.: Fifty-Third Supplement to the American Ornithologists' Union Check-List of North American Birds. In: The Auk, Jhrg. 129, Ausgabe 3 (2012) HTML-Dokument engl.
- Gerhardt et al. (Kindle Version - ohne Seiten) Conservation